
【题目】根据下表中烃的分子式排列规律,判断空格中烃的同分异构体的数目是( )
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
CH4 | C2H4 | C3H8 | C4H8 | C6H12 | C7H16 | C8H16 |
A.3
B.4
C.5
D.6
 名校通行证有效作业系列答案
名校通行证有效作业系列答案科目:高中化学 来源: 题型:
【题目】乙烯酮(CH2 =C=O)在一定条件下,能与含活泼氢的化合物发生如下的加成反应:CH2 =C=O+HA→![]() 。乙烯酮在一定条件下与下列试剂加成,其加成产物不正确的是( )
。乙烯酮在一定条件下与下列试剂加成,其加成产物不正确的是( )
A. 与HCl加成:![]()
B. 与CH3COOH加成:![]()
C. 与H2O加成:![]()
D. 与CH3CH2OH加成:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】炼锌厂产生的工业废渣——锌渣(除了含Zn 外,还含有Fe、Al、Cd (镉)和SiO2等杂质),利用锌渣制取并回收ZnSO4·7H2O 和金属镉(Cd)是一个有益的尝试,流程如下:
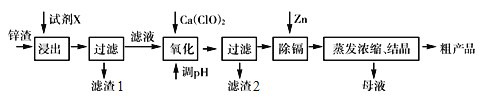
已知:金属活动性Zn> Cd
物质 | Fe(OH)3 | Al(OH)3 | Zn(OH)2 | Cd(OH)2 | Fe(OH)2 |
完全沉淀时的PH | ≥3.2 | ≥4.7 | ≥6.5 | ≥9.4 | ≥9.7 |
试回答下列问题:
(1)第一步浸出时用到的试剂X为__________,滤渣1的成分是___________。
(2)加入Ca(ClO)2 的目的是氧化Fe2+,写出反应的离子方程式____________________。
(3)调节pH 过程可以选用;本流程的pH 调节一般调至5,其目的是_____________________。
(4)写出过滤后加入过量的锌粉反应的离子方程式__________________。
(5)在蒸发浓缩操作时,要保持一定的酸度,其目的是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)25 ℃,pH=10的NaOH溶液与PH=12的NaOH溶液等体积混合,则混合后溶液中的PH 约为____________________。(已知 lg2=0.3)
(2)T℃ ,水的离子积常数Kw= 1×10-12,欲使PH=1的硫酸溶液与PH=13的NaOH溶液混合后呈中性,则硫酸溶液与NaOH溶液的体积比为_________________。
(3)已知25 ℃,碳酸的电离平衡常数Ka1= 4.0×10-7,Ka2= 5.6×10-11,则该温度下NaHCO3的水解平衡常数Kh=________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某恒温密闭容器发生可逆反应Z(?)+W(?)X(g)+Y(?)△H,在t1时刻反应达到平衡,在t2时刻缩小容器体积,t3时刻再次达到平衡状态后未再改变条件.下列有关说法中正确的是( ) 
A.Z和W在该条件下至少有一个是为气态
B.t1~t2时间段与t3时刻后,两时间段反应体系中气体的平均摩尔质量不可能相等
C.若该反应只在某温度T0以上自发进行,则该反应的平衡常数K随温度升高而增大
D.若在该温度下此反应平衡常数表达式为K=c(X),则t1~t2时间段与t3时刻后的X浓度不相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25°C时,某化学实验小组同学向用大理石和稀盐酸制备CO2后的残留液中滴加碳酸钠溶液,在溶液中插入pH传感器,测得pH变化曲线如图所示.下列说法不正确的是( ) 
A.开始时溶液pH=2是因为残留液中还有盐酸剩余
B.BC段表示随着碳酸钠溶液的滴入,CaCO3沉淀的质量逐渐增加
C.滴入500滴碳酸钠溶液后溶液中c(OH﹣)>c(H+)
D.AB发生的反应为:Ca2++CO32﹣═CaCO3↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:4NH3(g)+5O2(g)=4NO(g)+6H2(g);△H=-1025kJ/mol该反应是一个可逆反应。若反应物起始物质的量相同,下列关于该反应的示意图不正确的是( )

A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、W为六种前四周期元素,它们的原子序数依次增大.A与D同主族,可形成DA型离子化合物,B与C同周期且相邻,C与E同主族,E2﹣与Ar原子具有相同的电子层结构,W的合金用量最大、用途最广.请回答下列问题:
(1)W元素在元素周期表中的位置为 .
(2)下列说法正确的是
A.原子半径:A<B<C<D<E
B.D2WC4可以用来做消毒剂和净水剂
C.A4B2C3中既含有离子键又含有共价键
D.D2C2与EC2可以反应生成D2EC3和C2
(3)灼热的碳能与B的最高价氧化物对应水化物的浓溶液反应,化学反应方程式为 .
(4)向盛有A2C2溶液的试管中加入几滴酸化的WEC4溶液,溶液变成棕黄色,发生反应的离子方程式为;一段时间后,溶液中有大量气泡出现,随后溶液温度升高,有红褐色沉淀生成,则产生气泡的原因是;生成沉淀的原因是(用平衡移动原理解释).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com