
【题目】下列各组物质能用括号内的试剂等鉴别的是 ()
A.![]() 和
和![]() 两种溶液(焰色反应)
两种溶液(焰色反应)
B.NaCl和![]() 两种溶液(激光笔)
两种溶液(激光笔)
C.![]() 溶液
溶液![]() 两种溶液(NaOH溶液)
两种溶液(NaOH溶液)
D.![]() 和
和![]() 两种溶液(KSCN溶液)
两种溶液(KSCN溶液)
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某无色溶液W由下列离子中的若干种组成:H+、![]() 、Fe3+、Ba2+、Mg2+、
、Fe3+、Ba2+、Mg2+、![]() 、I-、OH-、
、I-、OH-、![]() 。向W中加入铝粉后有气体Y、含铝元素的离子X等生成。若不考虑水的电离,则下列说法中正确的是
。向W中加入铝粉后有气体Y、含铝元素的离子X等生成。若不考虑水的电离,则下列说法中正确的是
A.X一定是Al3+B.Y一定是H2
C.W中最多含有6种离子D.溶液中不可能含![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上通常利用SiO2 和碳反应来制取硅,写出反应的化学方程式___________________。
工业上还可以利用镁制取硅,反应为2Mg+SiO2 = 2MgO+Si,同时会发生副反应:2Mg + Si = Mg2Si。如图是进行Mg与SiO2反应的实验装置,试回答下列问题:

(1)由于O2和H2O(g)的存在对该实验有较大影响,实验中应通入气体X作为保护气,试管中的固体药品可选用________(填序号)。
a.石灰石 b.锌粒 c.纯碱
(2)实验开始时,必须先通一段时间X气体,再加热反应物,其理由是 ___________________________;当反应引发后,移走酒精灯,反应能继续进行,其原因是______________________。
(3)反应结束后,待冷却至常温时,往反应后的混合物中加入稀盐酸,可观察到闪亮的火星,产生此现象的原因是副产物Mg2Si遇盐酸迅速反应生成SiH4(硅烷)气体,然后SiH4自燃.用化学方程式表示这两个反应①________________________②___________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知一定温度和压强下,合成氨反应:N2(g)+3H2(g)=2NH3(g) ΔH=-92.0 kJ/mol,将1 mol N2和3 mol H2充入一密闭容器中,保持恒温恒压,在催化剂存在时进行反应,达到平衡时,测得N2的转化率为20%。若在相同条件下,起始时向该容器中充入2 mol NH3,反应达到平衡时的热量变化是( )
A.吸收18.4 kJ热量B.吸收73.6 kJ热量
C.放出18.4 kJ热量D.放出73.6 kJ热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】容积均为1L的甲、乙两个恒容容器中,分别充入2molA、2molB和1molA、1molB,相同条件下,发生下列反应:A(g)+B(g)![]() xC(g) △H<0。测得两容器中c(A)随时间t的变化如图所示,下列说法不正确的是
xC(g) △H<0。测得两容器中c(A)随时间t的变化如图所示,下列说法不正确的是
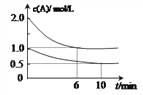
A. x=1
B. 此条件下,该反应的平衡常数K=4
C. 给乙容器升温可缩短反应达平衡的时间但不能提高平衡转化率
D. 甲和乙中B的平衡转化率相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学组装了如图所示的电化学装置,电极Ⅰ为Al,其他均为Cu,则下列说法正确的是( )

A.电流方向:电极Ⅳ→A→电极Ⅰ
B.电极Ⅰ发生还原反应
C.电极Ⅱ逐渐溶解
D.电极Ⅲ的电极反应:Cu2++2e- =Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学为了获取在Fe(OH)2制备过程中,沉淀颜色的改变与氧气有关的实验证据,用下图所示装置进行了如下实验(夹持装置已略去,气密性已检验)。
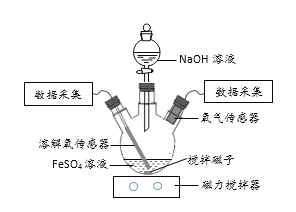
(进行实验)
实验步骤:Ⅰ.向瓶中加入饱和FeSO4溶液,按图1所示连接装置;
Ⅱ.打开磁力搅拌器,立即加入10% NaOH溶液;
Ⅲ.采集瓶内空气中O2含量和溶液中O2含量(DO)的数据。
实验现象:生成白色絮状沉淀,白色沉淀迅速变为灰绿色,一段时间后部分变为红褐色。
实验数据:
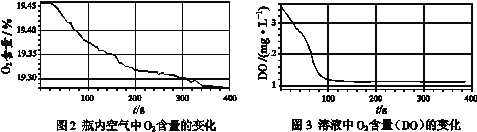
(解释与结论)
(1)搅拌的目的是__________________________。
(2)生成白色沉淀的离子方程式是____________。
(3)红褐色沉淀是__________________________。(填化学式)
(4)通过上述实验,可得到“在Fe(OH)2制备过程中,沉淀颜色改变与氧气有关”的结论,其实验证据是______________________。
(5)写出白色沉淀最终生成红褐色转化的方程式:___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在同温、同压下,下列三个反应放出的热量分别用a、b、c表示,则a、b、c的关系是( )
2H2(g)+O2(g)===2H2O(g) ΔH=-a kJ·mol-1 ①
2H2(g)+O2(g)===2H2O(l) ΔH=-b kJ·mol-1 ②
H2(g)+1/2O2(g)===H2O(g) ΔH=-c kJ·mol-1 ③
A.a>b, b=2cB.a=b=cC.a<b,c=a/2D.无法比较
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏加德罗常数的值为NA,下列叙述中错误的是( )
①标准状况下,2.24L水中含有0.1 NA个水分子
②常温常压下,32gSO2 含有的分子数约为3.01×1023
③2 molNaOH的摩尔质量为80g/mol
④H2的气体摩尔体积约为22.4L/mol
⑤室温下,32gO2和O3的混合气体中含有的氧原子数为2NA
⑥2mol/L的CaCl2溶液中Cl-的数目为4NA
⑦常温常压下,1mol氦气含有的原子数为NA
⑧11.2L氯气中含有 NA个氯原子
⑨在标准状况下,22.4L由N2和N2O组成的混合气体中,所含有的氮原子的物质的量为2mol
⑩标准状况下14gCO含有的核外电子数为10NA
A.①③④⑥⑧⑩B.①④⑤⑥⑧⑨
C.①②④⑥⑧⑨D.②③④⑤⑦⑩
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com