
在可逆反应N2+3H2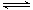 2NH3中,表示该反应速率最快的是
2NH3中,表示该反应速率最快的是
A.v(H2)=0.2 mol·L-1·min-1 B.v(N2)==0. 2 mol·L-1·min-1
C.v(NH3)=0.3 mol·L-1·min-1 D.v(N2)==0. 004 mol·L-1·s-1
| 温度 | 350℃ | 425℃ | 490℃ |
| 平衡常数 | 66.9 | 54.4 | 45.9 |
 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案科目:高中化学 来源: 题型:
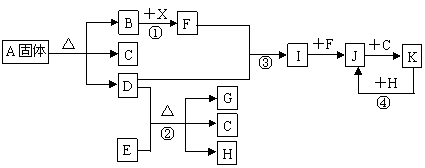 下图表示各物质之间的转化关系。已知:常温下B、D、F、G、I、J是气体, F、G是空气中的主要成分,D是一种碱性气体。A中阴、阳离子个数比是1∶1, E是一种黑色氧化物,H是紫红色金属单质。(部分生成物和反应条件省略)
下图表示各物质之间的转化关系。已知:常温下B、D、F、G、I、J是气体, F、G是空气中的主要成分,D是一种碱性气体。A中阴、阳离子个数比是1∶1, E是一种黑色氧化物,H是紫红色金属单质。(部分生成物和反应条件省略)
请按要求填空:
(1)A物质的化学式是 ▲ ;
(2)反应③的化学方程式是 ▲ ;
反应④的离子方程式是 ▲ ;
(3)反应①中产生标准状况下1.12L气体F,则转移的电子数目是 ▲ ;
(4)检验溶液A中阳离子的方法是 ▲
;
(5)反应②中氧化剂是 ▲ ;
查看答案和解析>>
科目:高中化学 来源: 题型:
向某密闭容器中加入0.3 mol A、0.1 mol C和一定量的B三种气体。一定条件下发生反应,各物质的浓度随时间变化如甲图所示[t0~t1阶段的c(B)变化未画出]。乙图为t2时刻后改变条件平衡体系中正、逆反应速率随时间变化的情况,且四个阶段都各改变一种反应条件且互不相同,t3~t4阶段为使用催化剂。下列说法中正确的是
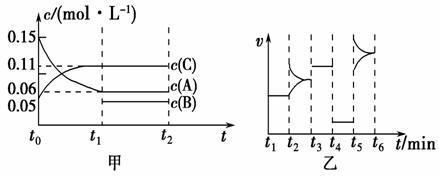
A.若t1=15 s,用A的浓度变化表示t0~t1阶段的平均反应速率为0.004 mol·L-1·s-1
B.该容器的容积为2 L,B的起始物质的量为0.02 mol
C.t4~t5阶段改变的条件一定为减小压强
D.t5~t6阶段,容器内A的物质的量减少了0.06 mol,而此过程中容器与外界的热交换总量为a kJ,该反应的热化学方程式:3A(g) B(g)+2C(g) ΔH=-50a kJ·mol-1
B(g)+2C(g) ΔH=-50a kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是
A.乙醇和汽油都是可再生能源,应大力推广“乙醇汽油”
B.反应NH3(g) + HCl (g)== NH4Cl(s)在室温下可自发进行,则该反应的△H <0
C.用电解水的方法制取大量氢气可以缓解能源不足的问题
D.升高温度活化能降低
查看答案和解析>>
科目:高中化学 来源: 题型:
已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ΔH=-57.3 kJ/mol,则下列说法中正确的是
A.浓硫酸和稀NaOH溶液反应,生成 l mol水时放热57.3 kJ
B.含l molH2SO4的稀硫酸与足量稀NaOH溶液中和后,放热为57.3 kJ
C.1L 0.l mol/L CH3COOH与1L 0.l1 mol/L NaOH溶液反应后放热为5.73 kJ
D.1L 0.l mol/L HNO3与1L 0.l1 mol/L NaOH溶液反应后放热为5.73 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
已知A、B、C均为气体,A 与B反应生成C。某温度下,向容积固定的密闭容器中充入一定浓度的A与B,A的起始浓度为1mol/L、B的起始浓度x mol/L。反应过程中密闭容器内的压强始终不变,反应进行2min后A的浓度为0.8mol/L,B的浓度为0.6mol/L,C的浓度为0.6mol/L。
(1)x = ________
(2)2min内反应的平均速率为:v (B) = _________________
(3)用不同物质表示该反应速率,其数值之间的关系是:v (B) =__________v (C)
(4)该反应的化学方程式为:____________________________________________________
(5)该反应平衡常数K的表达式是:K= ,该温度下,反应的平衡常数是_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
已知同温度下的溶解度:Zn(OH)2>ZnS,MgCO3>Mg(OH)2;就溶解或电离出S2-的能力而言,FeS>H2S>CuS,则下列离子方程式错误的是
A.Mg2+ + 2HCO3- + 2Ca2+ + 4OH-= Mg(OH)2↓+ 2CaCO3↓+ 2H2O
B.Cu2+ + H2S = CuS↓+ 2H+
C.Zn2+ + S2- + 2H2O = Zn(OH)2↓+ H2S↑
D.FeS + 2H+ = Fe2+ + H2S↑
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验能达到目的的是
A.只滴加氨水鉴别NaCl、AlCl3、MgCl2、Na2SO4四种溶液
B.将NH4Cl溶液蒸干制备NH4Cl固体
C.用可见光束照射以区别溶液和胶体
D.用萃取分液的方法除去酒精中的水
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com