


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、5.6 g铁与过量盐酸反应转移的电子数为0.3NA |
| B、常温下,10ml1mol/LNa2CO3溶液中阴离子总数大于0.01NA |
| C、标准状况下,22.4 L氦气与22.4 L氢气所含原子数均为2NA |
| D、30gSiO2中含Si-O键数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验操作 | 实验现象 | 结 论 | ||
| A | 测定等浓度的Na2CO3和Na2SO3溶液的pH | 前者pH比后者的大 | 非金属性:S>C | ||
| B | SO2通入酸性高锰酸钾溶液 | 高锰酸钾溶液褪色 | SO2具有漂白性 | ||
| C | 向某溶液中滴加稀NaOH溶液,将湿润红色石蕊试纸置于试管口 | 试纸不变蓝 | 原溶液中无N
| ||
| D | 向等浓度的KCl、KI混合液中滴加AgNO3溶液 | 先出现黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②⑤ | B、②③④ |
| C、②③⑥ | D、全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| t/s | 0 | t1 | t2 | t3 | t4 |
| n(SO3)/mol | 0 | 0.8 | 1.4 | 1.8 | 1.8 |
A、反应在前t1 s 的平均速率v(O2)=
| ||
| B、保持其他条件不变,体积压缩到1.0L,平衡常数将增大 | ||
| C、相同温度下,起始时向容器中充入4mol SO3,达到平衡时,SO3的转化率大于10% | ||
D、保持温度不变,向该容器中再充入2mol SO2、1mol O2,反应达到新平衡时
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
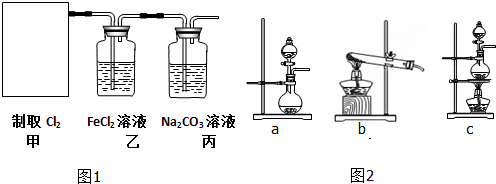
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com