
【题目】有甲、乙两位同学均想利用原电池反应检测金属的活动性顺序,两人均用镁片和铝片作电极,但甲同学将电极放入6molL﹣1的H2SO4溶液中,乙同学将电极放入6molL﹣1的NaOH溶液中,如图所示.
(1)甲中SO42﹣移向极(填“铝片”或“镁片”).写出甲中正极的电极反应式 .
(2)乙中负极为 , 总反应的离子方程式: . 此反应中氧化剂和还原剂的物质的量之比为 .
(3)上述实验也反过来证明了“直接利用金属活动性顺序表判断原电池中的正负极”这种做法(填“可靠”或“不可靠”).如不可靠,请你提出另一个判断原电池正负极的可行性实验方案(如可靠,此空可不填).
【答案】
(1)镁片;2H++2e﹣=H2↑
(2)铝片;2Al+2OH﹣+2H2O=2AlO2﹣+3H2↑;3:1
(3)不可靠;在两电极之间连上一个电流计测电流方向,判断原电池的正负极
【解析】(1)镁易失电子作负极、Al作正极,负极上镁发生氧化反应、正极上氢离子发生还原反应,原电池中阴离子向负极移动,所以硫酸根离子流向镁片,正极的电极反应式为:2H++2e﹣=H2↑,所以答案是:镁片;2H++2e﹣=H2↑;(2)在碱性介质中铝比镁活泼,所以乙池中铝易失电子作负极、镁作正极,负极上铝失电子发生氧化反应,总的电极反应式为:2Al+2OH﹣+2H2O=2AlO2﹣+3H2↑,氧化剂是水,还原剂是铝,而1mol的水电离产生1mol的氢离子,1mol的氢离子得到1mol的电子,而1mol的转移3mol的电子,所以氧化剂和还原剂的物质的量之比为3:1,所以答案是:铝片,2Al+2OH﹣+2H2O=2AlO2﹣+3H2↑,3:1;(3)上述实验说明,“直接利用金属活动性顺序表判断电池中的正负极”并不考可靠,最好是接一个电流计,通过观察电流方向判断原电池的正负极,所以答案是:不可靠;在两电极之间连上一个电流计测电流方向,判断原电池的正负极.


科目:高中化学 来源: 题型:
【题目】有Fe、Mg 、Al、Cu四种金属,若两两混合,取混合物26g与足量的稀硫酸作用,产生11.2L H2(标准状况),则混合物可能的组合方式最多有
A. 2种 B. 3种 C. 4种 D. 5种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是 ( )
A. SO2的摩尔质量为64g
B. 气体的摩尔体积约为22.4L/mol
C. 12g12C中所含碳原子数即为阿伏加德罗常数
D. 4gNaOH溶于1L水所得溶液的物质的量浓度为0.1mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是()
A.用福尔马林进行居室内环境消毒
B.聚酯纤维是制作运动衣的材料,是水溶性纤维
C.人体内无纤维素酶,故纤维素在人体内无法被分解利用
D.现代轨道交通中用到大量的合金钢,它的主要成分是碳
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常将铬镀在其他金属表面,同铁、镍组成各种性质的不锈钢,在如图装置中,观察到图1装置铜电极上产生大量的无色气泡,而图2装置中铜电极上无气体产生,铬电极上产生大量有色气体,则下列叙述正确的是( )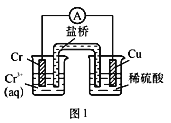
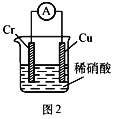
A.图1为原电池装置,Cu电极上产生的是O2
B.图2装置中Cu电极上发生的电极反应式为:Cu﹣2e﹣═Cu2+
C.由实验现象可知:金属活动性Cu>Cr
D.两个装置中,电子均由Cr电极流向Cu电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,向还原铁粉中加入少量的炭粉,混合均匀后,撒入内壁用NaCl溶液润湿过的具支试管中,塞紧橡皮塞.几分钟后,打开止水夹,观察到导管中水柱上升.对此过程所作的分析正确的是( )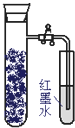
A.碳粉在电化学腐蚀过程中作负极
B.炭粉被氧化
C.发生了吸氧腐蚀
D.发生了析氢腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.1 mol CO2 的质量为44g/mol
B.H2SO4的摩尔质量为98
C.标准状况下,气体摩尔体积约为22.4 L
D.O2的相对分子质量为32
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述不正确的是( )
A. CH4与C3H8互为同系物B. C5H12有三种同分异构体
C. 乙烷与氯气在光照条件下能发生取代反应D. 所有烷烃中均有碳碳单键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g)2CO(g),平衡时,体系中气体体积分数与温度的关系如图所示:已知气体分压(P分)=气体总压(P总)×体积分数,下列说法正确的是( ) 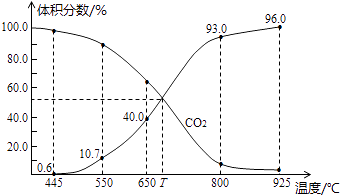
A.550℃时,若充入惰性气体,v正 , v退均减小,平衡不移动
B.650℃时,反应达平衡后CO2的转化率为25.0%
C.T℃时,若充入等体积的CO2和CO,平衡向逆反应方向移动
D.925℃时,用平衡分压代替平衡浓度表示的化学平衡常数Kp=24.0P总
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com