
 氨气是一种重要的化工产品,是生产铵盐、尿素等的原料.现有如下两种合成氨的途径:
氨气是一种重要的化工产品,是生产铵盐、尿素等的原料.现有如下两种合成氨的途径:| 时间/min | 0 | 30 | 70 | 80 | 100 |
| n(CO2)/mol | 0.10 | 0.060 | 0.040 | 0.040 | 0.040 |
分析 (1)Ⅰ.N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1
Ⅱ.2N2(g)+6H2O(l)?4NH3(g)+3O2(g)△H=+1530.0kJ/mol
根据盖斯定律$\frac{Ⅰ×2-Ⅱ}{6}$计算得到;
(2)化学反应达到化学平衡状态时,正逆反应速率相等,且不等于0,各物质的浓度不再发生变化,由此衍生的一些物理量不发生变化,以此进行判断,得出正确结论;
(3)①增大浓度,加快化学反应速率;
②根据等效平衡进行判断;
③根据平衡常数的定义进行计算;
④升高温度,平衡逆向移动,氨气的转化率减小;
⑤根据电解原理书写电极反应式,并进行相关计算.
解答 解:(1)Ⅰ.N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1
Ⅱ.2N2(g)+6H2O(l)?4NH3(g)+3O2(g)△H=+1530.0kJ/mol
根据盖斯定律$\frac{Ⅰ×2-Ⅱ}{6}$得,H2(g)+$\frac{1}{2}$O2(g)?H2O(l)△H=$\frac{-92.4×2-1530}{6}$=-285.8kJ/mol
故答案为:H2(g)+$\frac{1}{2}$O2(g)?H2O(l)△H=-285.8kJ/mol;
(1)单位时间内:①生成3n mol H2是正反应,同时生成2n mol NH3为逆反应,且化学反应速率之比等于化学计量数之比,故正逆反应速率相等,故①正确;
②用NH3、N2、H2表示反应速率比为2:1:3,化学反应速率之比等于化学计量数之比,与平衡无关,故②错误;
③密度=$\frac{总质量}{体积}$,总质量不变,体积不变,故混合气体的密度不再改变不能作为判断是否达到化学平衡状态的依据,故③错误;
④反应前后气体的化学计量数之和不等,故混合气体压强不再改变可作为判断是否达到化学平衡状态的依据,故④正确;
⑤平均相对分子质量=$\frac{总质量}{总物质的量}$,总质量不变,总物质的量在变,故混合气体平均相对分子质量不再改变可作为判断是否达到化学平衡状态的依据,故⑤正确;故在恒容密闭容器中达到平衡的标志有①④⑤,
故选C;
(3)①20min时,n(CO2 )=0.06~0.10mol,80min时,n(H2O)=0.06mol,n(CO2 )>n(H2O),故20min时,υ正(CO2 )>80min时.υ逆(H2O),故答案为:>;
②原始投料n(CO2 ):n(NH3)=0.1mol:0.4mol=1:4,新增投料n(CO2 ):n(NH3)=0.05mol:0.2mol=1:4,恒温恒容,投料比相同,相当于增大压强,有利于平衡正向移动,故平衡后CO2的转化率增大,故答案为:增大;
③平衡时,c(CO2)=0.04÷2=0.02mol/L,c(NH3)=(0.4-0.06×2)÷2=0.14mol/L,c(H2O)=0.06÷2=0.03mol/L,故K=$\frac{0.03}{0.02×0.14×0.14}$=76.53,故答案为:76.53;
④利用三段式计算出30min时NH3的转化率为20%,70min时NH3的转化率为30%,然后模仿已有曲线绘制出曲线,注意70min前的图象不能画成直线,无论是吸热还是放热反应,温度升高时,达到平衡的时间都会缩短;该反应是放热反应,温度升高,平衡会逆向移动,所以NH3的转化率会减小,故答案为:B;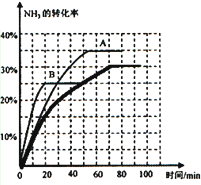 .
.
点评 本题考查盖斯定律的应用、化学平衡状态的判断、化学反应速率和化学平衡的影响因素、平衡常数的计算等,综合性较强,难度中等.


科目:高中化学 来源: 题型:选择题
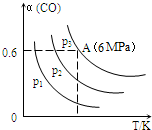
| A. | p1>p2>p3 | |
| B. | 若断裂碳氢键、氢氢键的速率相等,则该反应为平衡状态 | |
| C. | 已知从反应开始到平衡点A需要时间10min.在0~10分钟内的平均速率v(H2)=0.18mol/(L•min) | |
| D. | A点的平衡常数Kp=$\frac{1}{64}$(Kp是用平衡时各组分的分压代替其浓度的平衡常数.组分分压=混合气体总压强X该组分的物质的量分数) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
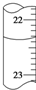 下列说法正确的是( )
下列说法正确的是( )| A. | ①② | B. | ①③④ | C. | ③④⑤ | D. | ②③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=2的CH3COOH溶液的浓度小于pH=2的盐酸的浓度 | |
| B. | 向NaHC03溶液中加入少量NaOH固体,可抑制HCO3-的水解,使c(HCO-)增 大 | |
| C. | Na2C03溶液中:即c(Na+)>C(CO32-)>C(OH-)=C(HCO3-)>C(H+) | |
| D. | 将任意量的CH3COOH溶液与NaOH溶液混合,其混合溶液均存在:C(Na+)+c(H+)=C(CH3COO-)+C(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molCO2通入750mL 2mol/LKOH溶液中:(K+)=2 c(CO32-)+c(HCO3-)+c(H2CO3) | |
| B. | 加入铝粉有气泡产生的溶液中存在离子:Na+、NH4+、Fe2+、NO3- | |
| C. | 等物质的量Na2CO3、Ca(OH)2、HCl物质混合反应的离子方程式:CO32-+Ca2++H++OH-=CaCO3↓+H2O | |
| D. | Ca与O元素形成化合物中只有离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 53 | B. | 78 | C. | 131 | D. | 184 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
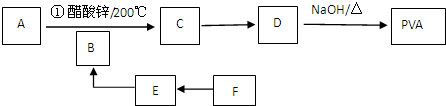
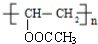 +n NaOH→
+n NaOH→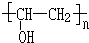 +n CH3COONa.
+n CH3COONa.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
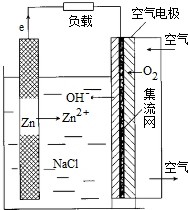
| A. | 放电时,电池正极反应式为:O2+H++4e-=2H2O | |
| B. | 增大空气进气口直径,可增大电池输出能力并延长电池使用寿命 | |
| C. | 放电时,每通入2.24L空气(标准状况),理论上负极需要消耗13gZn | |
| D. | 电池用完后,只需更换封装好的锌粉或电池锌板即可 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com