
pH<7的x溶液中含有三种常见金属阳离子,用x溶液进行如下实验:
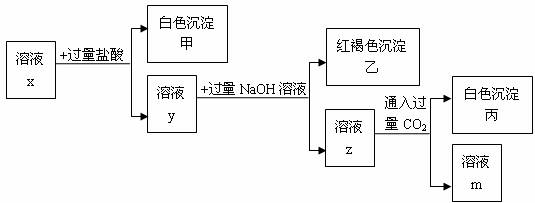
(1)根据有白色沉淀甲生成,判断x溶液中有 阳离子;根据有白色沉淀丙生成,判断x溶液中有 阳离子。
(2)写出由溶液y生成红褐色沉淀乙的离子方程式 。
(3)x溶液中一定含有的阴离子是 。
(4)根据上述实验 (填“能”或“不能”)确定x溶液中的第3种金属阳离子,理由是 。
科目:高中化学 来源:2012届山西省山大附中高三第一次模拟试题理综化学试卷(带解析) 题型:填空题
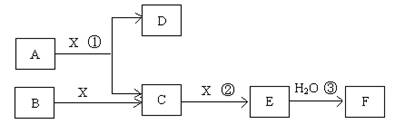
(14分)已知由短周期常见元素形成的纯净物A、B、C、D、E、F、X转化关系如下图所示,B、X为单质,D常温下为无色液体,A、B含同一种元素。(某些产物可能略去)
请回答下列问题:
(1)若E是有色气体,F是一元强酸,反应①是工业制备F的第一步反应。
①写出A与X反应的化学方程式: 。
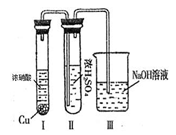
②有人认为“浓H2SO4可以干燥气体E”。某同学为了验证该观点是否正确,用下图装置进行实验。实验过程中,浓H2SO4中未发现有气体逸出,且浓H2SO4由无色变为红棕色,由此你得出的结论是 。
③已知常温下1 mol气体E发生反应③放出46kJ热量,写出气体E与H2O反应的热化学方式 。
④在常温下,向V1L pH=a的A溶液中加入V2L pH=b的盐酸,且a+b=14,若反应后溶液的pH<7,则V1和V2的关系为V1 V2(填>、<、无法确定),所得溶液中各种离子的浓度由大到小的顺序可能是 。(写出一种情况即可)
(2)若E为无色无味气体,F是二元弱酸。
①E的电子式为 ;
②将少量气体E通入氢氧化钡溶液中得不溶物G,G的KSP=8.1×10-9。现将该沉淀放入0.1mol/L的BaCl2溶液中,其KSP ,(填:增大、减小或不变),此时,组成不溶物G的阴离子在溶液中的浓度为 mol/L。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年广东省佛山市高三一模理综化学试卷(解析版) 题型:填空题
磷酸盐骨水泥具有良好的生物相容性和生物活性。医药工业利用共沉淀原理,通过控制Ca/P物质的量比n(Ca)/n(P)]制备相应产品[Ca5(PO4)3OH和Ca3(PO4)2的n(Ca)/n(P)分别为1.67和15]流程如下:

(注:Ca5(PO4)3OH和Ca3(PO4)2和CaHPO4均难溶于水;Ca(H2 PO4)2溶液pH<7)
下表为n(Ca)/n(P)=1.5时,不同pH值制得滤饼的产率以及分析结果:

(1)流程中强调“滴加速度100mL/45min的作用是 。流程中调pH选氨水,不选生石灰或石灰乳的理由是 。
(2)从表中数据分析生成Ca3(PO4)2时,“pH=x”中的x的最佳取值为 ,滤饼的化学成分Ca5(PO4)3OH、Ca3(PO4)2和CaHPO4和 。
(3)酸性条件下产率偏低的原因是 。
(4)“高温煅烧”滤饼,化学反应方程式为 。
(5)如图是生产羟基磷灰石时得到的实验曲线,依据图上信息计算磷的初始浓度为0.70mmol/L,pH=10.0条件下反应前10min内磷的沉淀速率为 。

查看答案和解析>>
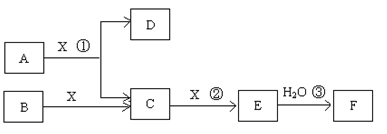
科目:高中化学 来源:2011-2012学年山西省高三第一次模拟试题理综化学试卷(解析版) 题型:推断题
(14分)已知由短周期常见元素形成的纯净物A、B、C、D、E、F、X转化关系如下图所示,B、X为单质,D常温下为无色液体,A、B含同一种元素。(某些产物可能略去)
请回答下列问题:
(1)若E是有色气体,F是一元强酸,反应①是工业制备F的第一步反应。
①写出A与X反应的化学方程式: 。
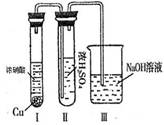
②有人认为“浓H2SO4可以干燥气体E”。某同学为了验证该观点是否正确,用下图装置进行实验。实验过程中,浓H2SO4中未发现有气体逸出,且浓H2SO4由无色变为红棕色,由此你得出的结论是 。
③已知常温下1 mol气体E发生反应③放出46kJ热量,写出气体E与H2O反应的热化学方式 。
④在常温下,向V1L pH=a的A溶液中加入V2L pH=b的盐酸,且a+b=14,若反应后溶液的pH<7,则V1和V2的关系为V1 V2(填>、<、无法确定),所得溶液中各种离子的浓度由大到小的顺序可能是 。(写出一种情况即可)
(2)若E为无色无味气体,F是二元弱酸。
①E的电子式为 ;
②将少量气体E通入氢氧化钡溶液中得不溶物G,G的KSP=8.1×10-9。现将该沉淀放入0.1mol/L的BaCl2溶液中,其KSP ,(填:增大、减小或不变),此时,组成不溶物G的阴离子在溶液中的浓度为 mol/L。
查看答案和解析>>
科目:高中化学 来源:山西省模拟题 题型:推断题
查看答案和解析>>
科目:高中化学 来源:山东省模拟题 题型:推断题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com