
| 代号 | 物质 | 结构简式 | 水中溶解度/g (25℃) | 熔点/℃ | 沸点/℃ |
| A | 邻-硝基苯酚 |  | 0.2 | 45 | 100 |
| B | 对-硝基苯酚 |  | 1.7 | 114 | 295 |


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:
| 代号 | 物质 | 结构式 | 水中溶解度/g (25℃) |
熔点/℃ | 沸点/℃ |
| A | 邻-硝基苯酚 | 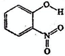 |
0.2 | 45 | 100 |
| B | 对-硝基苯酚 | 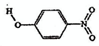 |
1.7 | 114 | 295 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 代号 | 物质 | 结构简式 | 水中溶解度/g (25℃) |
熔点/℃ | 沸点/℃ |
| A | 邻-硝基苯酚 |  |
0.2 | 45 | 100 |
| B | 对-硝基苯酚 | 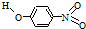 |
1.7 | 114 | 295 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
A.《物质结构与性质》
(1)前三周期元素中第一电离能最小的是 _______ (填元素符号),其基态原子的电子排布式为 _______ 。第二周期非金属元素形成的氢化物中化学键极性最大的是 _______
(填分子式),该物质在CCl4中的溶解度比在水中的溶解度 _______ (填“大”或“小”)。
 |
(3)晶格能的大小:MgO _______ NaCl,键能的大小:HBr _______ HI。(填“>”、“=”或“<”)
(4)下列物质的熔点高低顺序,正确的是 _______
A.金刚石>晶体硅>二氧化硅>碳化硅
B.CI4 > CBr4 > CCl4 > CH4
C.SiF4 > NaF > NaCl > NaBr
B《实验化学》
七水硫酸镁(MgSO4·7H2O)在印染、造纸和医药等工业上都有广泛的应用,利用化工厂生产硼砂的废渣-一硼镁泥可制取七水硫酸镁。硼镁泥的主要成分是MgCO3,还含有其他杂质(MgO、SiO2、Fe2O3、FeO、CaO、Al2O3、MnO等)。
表1 部分阳离子以氢氧化物形式完全沉淀时溶液的pH
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Mg(OH)2 |
| pH值 | 5.2 | 3.2 | 9.7 | 10.4 | 11.2 |
表2 两种盐的溶解度(单位为g/100g水)
| 温度 / ℃ | 10 | 30 | 40 | 50 | 60 |
| CaSO4 | 0.19 | 0.21 | 0.21 | 0.20 | 0.19 |
| MgSO4·7H2O | 30.9 | 35.5 | 40.8 | 45.6 | / |
硼镁泥制取七水硫酸镁的工艺流程如下:

根据以上流程图并参考表格pH数据和溶解度数据,试回答下列问题:
(1)过滤I的滤液中加入硼镁泥,调节溶液的pH=5~6,再加入NaClO溶液加热煮沸,将溶液中的Mn2+氧化成MnO2,反应的离子反应方程式为 _______ 。加热煮沸的主要目的是_ _______ 。
(2)沉淀B中除MnO2、SiO2外还含有 _______ (填化学式)等物质。
(3)检验过滤Ⅱ后的滤液中是否含有Fe3+的实验方法是 _______ ;
(4)沉淀C的化学式是 _______ 。过滤II需趁热过滤的理由是 _______
查看答案和解析>>
科目:高中化学 来源: 题型:
(12分)(1)前三周期元素中第一电离能最小的是 (填元素符号),其基态原子的电子排布式为 。第二周期非金属元素形成的氢化物中化学键极性最大的是 (填分子式),该物质在CCl4中的溶解度比在水中的溶解度 (填“大”或“小”)。
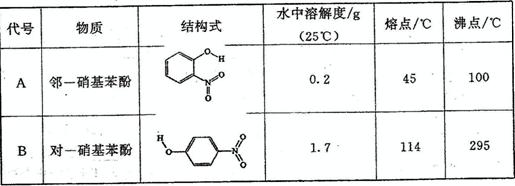
(2)物质形成分子间氢键和分子内氢键对物质性质的影响有显著差异。根据下表数据,形成分子间氢键的物质是 (填物质字母代号)。
(3)晶格能的大小:MgO NaCl,键能的大小:HBr HI。(填“>”、“=”或“<”)
(4)下列物质的熔点高低顺序,正确的是
A.金刚石>晶体硅>二氧化硅>碳化硅
B.CI4 > CBr4 > CCl4 > CH4
C.SiF4 > NaF > NaCl > NaBr
查看答案和解析>>
科目:高中化学 来源:2013届福建省高二上学期期末考试化学试卷 题型:填空题
(1)前三周期元素中第一电离能最小的是___________ (填元素符号),其基态原子的电子排布式为______________________。第二周期非金属元素形成的氢化物中化学键极性最大的是__________(填分子式)。
(2)物质形成分子间氢键和分子内氢键对物质性质的影响有显著差异。根据下表数据,形成分子间氢键的物质是___________ (填物质字母代号)。
|
代号 |
物质 |
结构简式 |
水中溶解度/g (25℃) |
熔点/℃ |
沸点/℃ |
|
A |
邻—硝基苯酚 |
|
0.2 |
45 |
100 |
|
B |
对—硝基苯酚 |
|
1.7 |
114 |
295 |
(3)电负性的大小:C___________O,键能的大小:HBr___________HI。(填“>”、“=”或“<”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com