
【题目】某学习小组按如下实验流程探究海带中碘含量的测定和碘的制取。
实验(一) 碘含量的测定
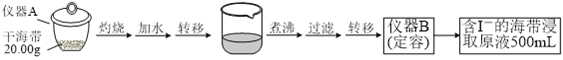
取0.0100 mol·Lˉ1的AgNO3标准溶液装入滴定管,取100.00 mL海带浸取原液至滴定池,用电势滴定法测定碘含量。测得的电动势(E) 反映溶液中c(Iˉ)的变化,部分数据如下表:
V(AgNO3)/mL | 15.00 | 19.00 | 19.80 | 19.98 | 20.00 | 20.02 | 21.00 | 23.00 | 25.00 |
E/mV | -225 | -200 | -150 | -100 | 50.0 | 175 | 275 | 300 | 325 |
实验(二) 碘的制取
另制海带浸取原液,甲、乙两种实验方案如下:
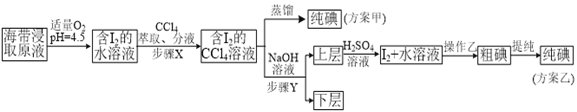
已知:3I2+6NaOH=5NaI+NaIO3+3H2O。
请回答:
(1)实验(一) 中的仪器名称:仪器A_________, 仪器 B___________________。
(2)该次滴定终点时用去AgNO3溶液的体积为20.00mL,计算得海带中碘的百分含量为_______%。
(3)①分液漏斗使用前须检漏,检漏方法为___________________。
②步骤X中,萃取后分液漏斗内观察到的现象是_______________。
③下列有关步骤Y的说法,正确的是___________________。
A.应控制NaOH溶液的浓度和体积 B.将碘转化成离子进入水层
C.主要是除去海带浸取原液中的有机杂质 D.NaOH溶液可以由乙醇代替
④实验(二) 中操作Z的名称是______________________。
(4)方案甲中采用蒸馏不合理,理由是_____________________。
【答案】 坩埚 500mL容量瓶 0.635% 向分液漏斗中加入少量水,检查旋塞处是否漏水;将漏斗倒转过来,检查玻璃塞是否漏水 液体分上下两层,下层呈紫红色 AB 过滤 主要由于碘易升华,会导致碘的损失
【解析】(1)根据仪器的构造可知,用于灼烧海带的仪器为坩埚;通过仪器B配制500mL含有碘离子的浸取液,需要使用500mL的容量瓶,故答案为:坩埚;500mL容量瓶;(2)20.00mL硝酸银溶液中含有硝酸银的物质的量为:0.0100mol/L×0.02L=0.0002mol,则500mL原浸出液完全反应消耗硝酸银的物质的量为:0.0002mol×![]() =0.001mol,说明20.00g该海带中含有0.001mol碘离子,所以海带中碘的百分含量为:
=0.001mol,说明20.00g该海带中含有0.001mol碘离子,所以海带中碘的百分含量为:![]() ×100%=0.635%;(3)①检查分液漏斗是否漏水的操作方法为:向分液漏斗中加入少量蒸馏水,检查旋塞处是否漏水;将漏斗倒转过来,检查玻璃塞是否漏水;②碘单质易溶于有机溶剂,微溶于水,且四氯化碳的密度大于水溶液,所以步骤X向含有碘单质的水溶液中加入四氯化碳后,混合液会分为上下两层,下层为四氯化碳的碘溶液,则下层呈紫红色;③A.发生反应3I2+6NaOH═5NaI+NaIO3+3H2O中,需要浓氢氧化钠溶液,所以应控制NaOH溶液的浓度和体积,选项A正确;B.根据反应3I2+6NaOH═5NaI+NaIO3+3H2O可知,步骤Y将碘转化成离子进入水层,选项B正确;C.该操作的主要目的是将碘单质转化成碘酸钠、碘化钠,将碘转化成离子进入水层,不是除去有机杂质,选项C错误;D.乙醇易溶于水和四氯化碳,将氢氧化钠换成乙醇,仍然无法分离出碘单质,选项D错误;答案选AB;④步骤Z将碘单质和水分离,由于碘单质不溶于水,可通过过滤操作完成;(4)方案甲中采用蒸馏操作,由于碘单质容易升华,会导致碘单质损失,所以甲方案不合理。
×100%=0.635%;(3)①检查分液漏斗是否漏水的操作方法为:向分液漏斗中加入少量蒸馏水,检查旋塞处是否漏水;将漏斗倒转过来,检查玻璃塞是否漏水;②碘单质易溶于有机溶剂,微溶于水,且四氯化碳的密度大于水溶液,所以步骤X向含有碘单质的水溶液中加入四氯化碳后,混合液会分为上下两层,下层为四氯化碳的碘溶液,则下层呈紫红色;③A.发生反应3I2+6NaOH═5NaI+NaIO3+3H2O中,需要浓氢氧化钠溶液,所以应控制NaOH溶液的浓度和体积,选项A正确;B.根据反应3I2+6NaOH═5NaI+NaIO3+3H2O可知,步骤Y将碘转化成离子进入水层,选项B正确;C.该操作的主要目的是将碘单质转化成碘酸钠、碘化钠,将碘转化成离子进入水层,不是除去有机杂质,选项C错误;D.乙醇易溶于水和四氯化碳,将氢氧化钠换成乙醇,仍然无法分离出碘单质,选项D错误;答案选AB;④步骤Z将碘单质和水分离,由于碘单质不溶于水,可通过过滤操作完成;(4)方案甲中采用蒸馏操作,由于碘单质容易升华,会导致碘单质损失,所以甲方案不合理。


科目:高中化学 来源: 题型:
【题目】下图表示氮及其化合物在一定条件下的转化关系:
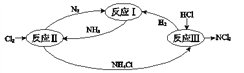
(1)反应I:N2(g)+3H2(g)![]() 2NH3(g) ΔH=–92 kJmol-1
2NH3(g) ΔH=–92 kJmol-1
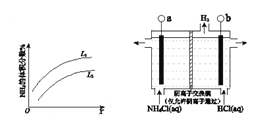
下左图是反应I中平衡混合气中NH3的体积分数随温度或压强变化的曲线,图中L(L1、L2)、X分别代表温度或压强。其中X代表的是________(填“温度”或“压强”)。
(2)①反应II的化学方程式是_________________________。
②反应II其中一步反应为2NH3(g)+3Cl2(g)=N2(g)+6HCl(g) ΔH=–462 kJmol-1
已知:N2(g)![]() 2N(g) Cl2(g)
2N(g) Cl2(g)![]() 2Cl(g)
2Cl(g)
断开1 mol H–N键与断开1 mol H–Cl键所需能量相差约为________kJ。
(3)反应III是利用上图所示装置电解制备NCl3(氯的化合价为+1),其原理是:NH4Cl+2HCl![]() NCl3 +3H2↑。
NCl3 +3H2↑。
①b接电源的_______极(填“正”或“负”)。② 阳极反应式是___________________。
(4)反应III得到的NCl3可以和NaClO2制备 ClO2,同时生成NH3,该反应的离子方程式是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是一种染料敏化太阳能电池的示意图。电池的一个电极由有机光敏染料(S)涂覆在TiO2纳米晶体表面制成,另一电极由导电玻璃镀铂构成,电池中发生的反应为:
TiO2/S→TiO2/S*(激发态)
TiO2/S*→TiO2/S*+e-
I3-+2e-→3I-
2TiO2/S++3I-→2TiO2/S+I3-
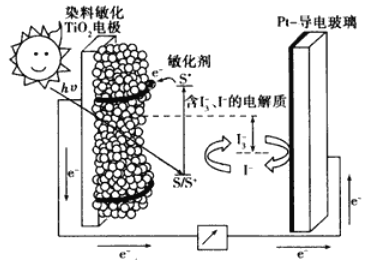
下列关于该电池叙述错误的是
A. 电池工作时,是将太阳能转化为电能
B. 电池工作时,I-离子在镀铂导电玻璃电极上放电
C. 电池中镀铂导电玻璃为正极
D. 电池的电解质溶液中I-和I3-的浓度不会减少
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是实验室制备氯气并进行一系列相关实验的装置(夹持及加热仪器已略)。
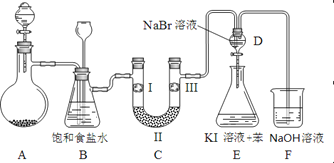
(1)制备氯气选用的药品为:漂粉精固体【主要成分为Ca(ClO)2】和浓盐酸,相关的化学反应方程式为:______________________________________________。
(2)装置B中饱和食盐水的作用是____________;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象_______________________。
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中I、II、III依次放入:________。
a | b | c | d | |
I | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
II | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
III | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
(4)设计装置D、E的目的是比较氯、溴、碘的非金属性。当向D中缓缓通入足量氯气时,可以看到无色溶液逐渐变为红棕色,说明氯的非金属性大于溴。打开活塞,将装置D中少量溶液加入装置E中,振荡。观察到的现象是____________________________。该现象_______(填“能”或“不能”)说明溴的氧化性强于碘,原因是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列描述中正确的是( )
A.CS2为V形的极性分子
B.ClO3﹣的空间构型为平面三角形
C.SiF4和SO32﹣的中心原子均为sp2杂化
D.SF6中有6对相同的成键电子对
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关试剂的保存方法,错误的是( )
A.浓硝酸保存在无色玻璃试剂瓶中
B.少量钠保存在煤油中
C.氢氧化钠溶液保存在带有橡皮塞的玻璃试剂瓶中
D.新制氯水通常保存在棕色试剂瓶中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气是一种有毒气体,在运输和储存过程中必须防止泄露。若储存液氯的钢瓶发生泄露,立即采取的措施中错误的是()
A.用浸有水的毛巾捂住口鼻B.将人群逆风向疏散
C.将人群向低处疏散D.向泄露地点撒一些石灰
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com