
【题目】下列有关电解质溶液的说法正确的是![]()
A.在蒸馏水中滴加浓![]() ,
,![]() 不变
不变
B.向![]() 溶液中滴加
溶液中滴加![]() 溶液,有沉淀和气体生成
溶液,有沉淀和气体生成
C.中和等体积等物质的量浓度的盐酸和醋酸,所消耗的氢氧化钠的物质的量相同
D.![]() 相等的
相等的![]() 溶液和
溶液和![]() 溶液,两溶液中水的电离程度相同
溶液,两溶液中水的电离程度相同
科目:高中化学 来源: 题型:
【题目】填写下列空白:
(1)写出表示含有8个质子、10个中子的原子的化学符号:________。
(2)周期表中位于第8纵行的铁元素属于第________族。
(3)下列几种物质:①Ca(OH)2②H2O2③He④H2S ⑤MgCl2 ,只含有离子键的是(选填序号,下同)_________;只含有极性共价键的化合物是________;
(4)HClO的结构式______,I2的电子式______。
(5)下列变化中:①干冰气化;②硝酸钾熔化;③KHSO4熔融;④蔗糖溶液水⑤硫酸溶于水;未破坏化学键的是 _____;
(6)下列不能说明氯元素原子得电子能力比硫元素原子得电子能力强的是_____________
①HCl的溶解度比H2S的大 ②HCl的酸性比H2S的强 ③HCl的稳定性比H2S的强④Cl2与铁反应生成FeCl3,而S与铁反应生成FeS ⑤HClO4的酸性比H2SO4的强 ⑥Cl2能与H2S反应生成S
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)已知拆开![]() 键、
键、![]() 键、
键、![]() 键分别需要吸收的能量为
键分别需要吸收的能量为![]() 、
、![]() 、
、![]() 。则由
。则由![]() 和
和![]() 反应生成1molHCl需要_______
反应生成1molHCl需要_______![]() 填“放出”或“吸收”
填“放出”或“吸收”![]() _________
_________![]() 的热量。
的热量。
(2)将等物质的量的A和B,混合于2 L的密闭容器中,发生如下反应 ![]() 。2min后,测得D的浓度为
。2min后,测得D的浓度为![]() mol/L ,
mol/L ,![]() ,C的反应速率是
,C的反应速率是![]() mol/(L·min)。则:
mol/(L·min)。则:
①x的值是__________;
②B的平均反应速率是____________;
③A在2min末的浓度是________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对化学平衡移动的分析中,不正确的是
①已达平衡的反应C(s)+H2O(g)![]() CO(g)+H2(g),当增加反应物物质的量时,平衡一定向正反应方向移动
CO(g)+H2(g),当增加反应物物质的量时,平衡一定向正反应方向移动
②已达平衡的反应N2(g)+3H2(g)![]() 2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率一定升高
2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率一定升高
③2.0molPCl3和1.0molCl2充入恒容的密闭容器中,发生反应:PCl3(g)+ Cl2(g)![]() PCl5(g)达平衡时,PCl5为0.4mol,如果此时移走1.0 molPCl3 和0.50 molCl2,在相同温度下再达平衡时PCl5的物质的量应大于0.20mol而小于0.40mol
PCl5(g)达平衡时,PCl5为0.4mol,如果此时移走1.0 molPCl3 和0.50 molCl2,在相同温度下再达平衡时PCl5的物质的量应大于0.20mol而小于0.40mol
④有气体参加的反应达平衡时,在恒压反应器中充入稀有气体,平衡不会发生移动
A.①④B.①②③C.②③④D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中存在如下反应:A (g)+3B(g) ![]() 2C(g);△H<0,某研究小组研究了只改变某一条件对上述反应的影响,并根据实验数据作出下列关系图:
2C(g);△H<0,某研究小组研究了只改变某一条件对上述反应的影响,并根据实验数据作出下列关系图:
![]()

下列判断一定错误的是
A.图Ⅰ研究的是压强对反应的影响,且乙的压强较高
B.图Ⅱ研究的是压强对反应的影响,且甲的压强较高
C.图Ⅱ研究的是温度对反应的影响,且甲的温度较高
D.图Ⅲ研究的是不同催化剂对反应的影响,且甲使用催化剂的效率较高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车安全气囊弹出时的反应为:![]() 下列说法正确的是( )
下列说法正确的是( )
A.自然界中氮、钠、硅元素均可以游离态形式存在
B.将反应后的固体溶于适量水,静置,通入![]() ,无现象
,无现象
C.微粒的半径:![]()
D.若反应中转移![]() 电子,则消耗
电子,则消耗![]() 的质量为
的质量为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】广东省有着丰富的海洋资源。海水提取食盐和Br2以后的盐卤可以用来制备纯净的MgCl2或MgO。盐卤中含有Mg2+、Cl-,还含有少量Na+、Fe2+、Fe3+和CO(NH2)2等.制备流程如图所示:
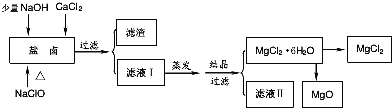
(1)滤渣的成分是____________(填化学式);滤液Ⅱ中所含的主要杂质离子是________(写离子符号)。
(2)用NaClO除去尿素CO(NH2)2时,生成物除盐外,都是能参与大气循环的物质,则该反应的化学方程式为_____________________;
(3)用MgCl26H2O制备无水MgCl2过程中,所需要的化学试剂是___________________;
(4)海水制溴过程中吸收潮湿空气中的Br2是利用SO2气体,SO2吸收Br2的离子方程式是_______________;SO2气体可来源于硫酸工业的尾气,同时,SO2尾气也可用氨水吸收,作为制备化肥的原料,SO2气体用氨水吸收得到的产物可能是___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应CO(g)+2H2(g)![]() 2CH3OH(g)在恒容密闭容器中进行。为探究温度、CO2等因素对该反应的影响,进行了4组实验,结果如右下表。下列说法不正确的是
2CH3OH(g)在恒容密闭容器中进行。为探究温度、CO2等因素对该反应的影响,进行了4组实验,结果如右下表。下列说法不正确的是
组序号 | 1 | 2 | 3 | 4 | |
反应温度/℃ | 225 | 235 | 225 | 235 | |
反应前气体的物质的量/mol | CO2 | 0 | 0 | 0.2 | 0.2 |
CO | 3.0 | 3.0 | 2.8 | 2.8 | |
H2 | 7.0 | 7.0 | 7.0 | 7.0 | |
平衡时CH3OH的体积分数/% | 4.9 | 8.8 | 36.5 | 50.7 | |
A.该反应的△H>0
B.当容器中压强不变时,反应达到平衡
C.CH3OH含量增大的原因是CO2
D.少量CO2能提高平衡时CH3OH的体积分数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如表所示为元素周期表的一部分,参照元素①~⑩在表中的位置,请回答下列问题:

(1)写出①和④两种元素原子按1:1组成的常见化合物的电子式______。
(2)用电子式表示⑥和⑨形成化合物的过程:______。
(3)③、⑧、⑩的最高价氧化物对应水化物的酸性由强到弱的顺序为 ______(用化学式表示)。
(4)已知周期表中存在对角相似规则,如②与⑦在周期表中处于对角线位置则化学性质相似,②的氧化物、氢氧化物也有两性,写出②的氢氧化物与⑥的氢氧化物反应的化学方程式 ______。
(5)⑤、⑥、⑩的离子半径由大到小的顺序为 ______(用离子符号表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com