
����Ŀ����ͼΪʵ����ijŨ�����Լ�ƿ�ϵı�ǩ���й����ݣ��Ը��ݱ�ǩ�ϵ��й����ݻش��������⣺
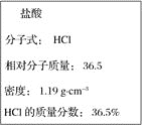
��1����Ũ������HCl�����ʵ���Ũ��Ϊ_______molL��1��
��2��ȡ����������ĸ�����ʱ�������������в�����ȡ����Ķ��ٶ��仯����______������ĸ����
A����Һ��HCl�����ʵ��� B����Һ��Ũ��
C����Һ��Cl������Ŀ D����Һ���ܶ�
��3��ijѧ����������Ũ���������ˮ����500 mL���ʵ���Ũ��Ϊ0.400 mol��L-1��ϡ���ᡣ
�ٸ�ѧ����Ҫ��ȡ________mL����Ũ����������ơ�
�������ƹ����У�����ʵ������������Ƶ�ϡ��������ʵ���Ũ���к�Ӱ�죿������������A��ʾ��ƫ��������B��ʾ��ƫС������C��ʾ����Ӱ��������
I������Ͳ��ȡŨ����ʱ���ӹ۲찼Һ��________��
II��ת��Ũ��Һʱ������������һ��Һ�彦������ƿ________��
III������ҡ�Ⱥ���Һ����ڿ̶���________��
IV������ʱ�����Ӷ�����������Һ��Ũ��________��
���𰸡�11.9 BD 16.8 B B C A
��������
��1��c��HCl��=1000�Ѧ�/M=![]() mol/L=11.9mol/L��
mol/L=11.9mol/L��
��2��A����Һ��HCl�����ʵ�����n=c��V����Һ�������HCl�����ʵ������������ⲻ����A����
B����Һ��Ũ��Ϊ�㶨��������������ĸı���ı䣬�������⣬B��ȷ��
C����Һ��Cl������Ŀ��N=c��V��NA����Һ�������Cl������Ŀ���������ⲻ����C����
D����Һ���ܶ�Ϊ�㶨��������������ĸı���ı䣬�������⣬D��ȷ��
��ΪBD��
��3����V1=C2V2/C1=0.400 mol/L![]() 500mL/11.9mol/L=16.8mL��
500mL/11.9mol/L=16.8mL��
��I�����ӹ۲찼Һ�浼�¶���Ũ��������ƫ����������ʵ���ƫС��������ҺŨ��ƫС��
II. ת��Ũ��Һʱ����Һ�彦�����������ʵ�����ƫС��������Һ�����ʵ���Ũ��ƫС��
III��ҡ�ȡ����ã�����Һ���½���δ���в�����������Һ������䣬���ʵ�����Ҳ���䣬������ҺŨ����Ӱ�죻
IV������ʱ�����Ӷ�����������Һ�����ƫС��������Һ��Ũ��ƫ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪Ca3(PO4)2��SiO2��C���¹��ȿ��Է�Ӧ�õ�CaSiO3��P4������CO����Ӧ���£�Ca3(PO4)2+SiO2+C![]() CaSiO3+P4��+CO����
CaSiO3+P4��+CO����
��1����ƽ�÷�Ӧ����ʽ�����������ת�Ʒ������Ŀ_____��
��2���÷�Ӧ�б���ԭ��Ԫ����___������������______��
��3��ÿ����24.0g̼ʱ����___�����ӷ���ת�ƣ�����P4__g��
��4����Ӧ���û�����壬����ɱ���£��������ܶ�Ϊ____g/L��������λС������
��5����÷�Ӧ���漰������Ԫ����ͬ����ĵ�Ԫ�أ������ˮ�帻Ӫ��������Ҫԭ����ij��ˮ��NH4Cl����Ϊ180 mg/L��
��д��NH4Cl�ĵ���ʽ____��
��Ϊ��ȥ��ˮ�е�NH4+����103L����ˮ�м���0.1 mol/LNaOH��Һ���������·�Ӧ��NH4++OH-=NH3+H2O������������ҪNaOH��Һ�����Ϊ___L��������������λС������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��п�̸ɵ�صĸ�������Ϊ��ؿ���Ľ���п�������DZ��������̺�̼�۰�Χ��ʯī�缫����������Ȼ�п���Ȼ�淋ĺ�״��õ�طŵ�����в��� MnOOH���Ͼɵ���е�Zn��MnԪ�صĻ��գ��Ի�����������Ҫ�����塣
��. ����пԪ�أ��Ʊ�ZnCl2
����һ�����ȥ���弰ʯī�缫�ĺ�ɫ��״���м�ˮ�����裬����ܽ⣬�����˷���ù������Һ��
�������������Һ���õ�ZnCl2��xH2O���塣
����������SOCl2��ZnCl2��xH2O��������ȡ��ˮZnCl2��
��ȡ��ˮZnCl2������ʣ���SOCl2����֤�������к���SO2(�гּ�����װ����) ��װ�����£�
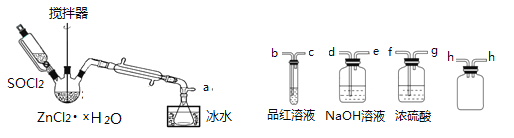
(��֪�� SOCl2��һ�ֳ��õ���ˮ�����۵㣭105�棬�е�79�棬140������ʱ�ֽ⣬��ˮ����ˮ�������������塣)
��1��д��SOCl2��ˮ��Ӧ�Ļ�ѧ����ʽ��______________________��
��2���ӿڵ�����˳��Ϊa��___��___�� h �� h ��___��___��___��e��______________
��. ������Ԫ�أ��Ʊ�MnO2
��3��ϴ�Ӳ���һ�õ��Ĺ��壬�жϹ���ϴ�Ӹɾ��ķ�����_________________________��
��4��ϴ�Ӻ�Ĺ��徭�������ɺ�������գ����յ�Ŀ��__________________________��
��. �������̴��ȵIJⶨ
��ȡ1.40g���պ�IJ�Ʒ������2.68g�����ƣ�Na2C2O4�����壬�ټ���������ϡ���Ტ���ȣ����ʲ����뷴Ӧ������ַ�Ӧ����ȴ����������Һת�Ƶ�100mL����ƿ��������ˮϡ�������ߣ�����ȡ��20.00mL����0.0200mol/L���������Һ���еζ����ζ����Σ����ĸ��������Һ�����ƽ��ֵΪ17.30mL��
��5��д��MnO2�ܽⷴӦ�����ӷ���__________________________________________��
��6����Ʒ�Ĵ���Ϊ______________________ ��
��7�������ղ���֣��ζ�ʱ���ĸ��������Һ���_____������ƫ�������� ƫС������ ����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧѧϰС��������ͼ��ʾװ���Ʊ����ռ�Cl2��������������֤ʵ�飨�г�װ����ȥ��������˵����ȷ���ǣ� ��
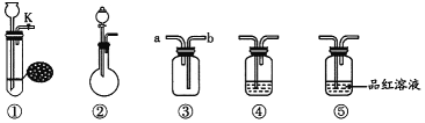
A. ��![]() ��Ũ�����Ʊ�
��Ũ�����Ʊ�![]() ʱ��ֻѡ
ʱ��ֻѡ![]()
B. ![]() ����
����![]() �ռ�ʱ��aΪ������
�ռ�ʱ��aΪ������
C. ![]() �м���NaBr��Һ��
�м���NaBr��Һ��![]() ��ͨ��
��ͨ��![]() ��Ӧ�������ã��²���Һ�ʳȺ�ɫ
��Ӧ�������ã��²���Һ�ʳȺ�ɫ
D. ![]() ��ͨ��
��ͨ��![]() ʹƷ����Һ��ɫ��ȡ����Һ���ȿɻָ���ɫ
ʹƷ����Һ��ɫ��ȡ����Һ���ȿɻָ���ɫ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ֳ������������Ľṹ����ͼ��ʾ������˵����ȷ���ǣ� ��
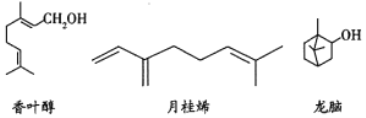
A. ��Ҷ�������Ի�Ϊͬ���칹�壬����ʽ��Ϊ![]()
B. ���ý����Ƽ�����Ҷ�����¹�ϩ
C. ���Է���������̼ԭ����ͬһ��ƽ����
D. 1mol�¹�ϩ�������![]() �����ӳɷ�Ӧ
�����ӳɷ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��̬��A�ڱ�״���µ��ܶ�Ϊ1.25 g��L��1��C�ܹ�����������Ӧ�� E��B��D���ܷ���������Ӧ���й����ʵ�ת����ϵ���£�

��ش�
(1) F�Ľṹ��ʽ______��
(2) A��B�ķ�Ӧ����______��
(3) C��D�Ļ�ѧ����ʽ______��
(4) ����˵������ȷ����______��
A����������Ͷ��B�У������Ƴ���ײ����������ķų�����
B��2 mol F���Է�Ӧ����1 mol��״����������ʽΪC4H6O5
C��G����NaHCO3��Һ�л��������
D��1 mol H�����뺬2 mol NaOH��ˮ��Һ��ȫ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���NaOH��Һ�����Ԫ����H2X��Һ�У������Һ�е�����Ũ������ҺpH�ı仯��ϵ����ͼ��ʾ������������ȷ���ǣ� ��
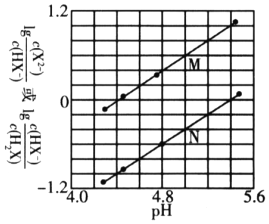
A. ����M��ʾ![]() ��pH�ı仯��ϵ
��pH�ı仯��ϵ
B. NaHX��Һ�Լ���
C. �������Һ������ʱ��![]()
D. ![]() ��������Ϊ
��������Ϊ![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������������������ˢ����ѧ���������ά�����ⷢ�������Ա���ۣ���Ҫ�ɷ�ΪBaCO3������SiO2��Fe2+��Mg2+�����ʣ��Ʊ����������������£�
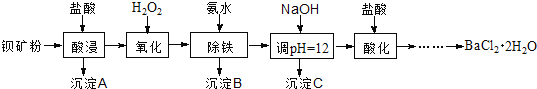
��֪��������Fe3+��Mg2+��ȫ������pH�ֱ��ǣ�3.4��12.4��
��1������A������Ϊ___________��
��2����Һ1��H2O2��Ŀ����___________��
��3����NaOH��Һ����pH��12.5���õ�����C����Ҫ�ɷ���___________��д��ѧʽ��
��4����Һ3���������ữ���پ�����Ũ��____________ϴ�ӣ���ո����һϵ�в�����õ�BaCl2��2H2O���塣
��5�������£���BaCl2��2H2O���Ƴ�0.2 mol/Lˮ��Һ��������Һ��Ӧ���ɵõ���������������д���÷�Ӧ�����ӷ���ʽ___________����֪Ksp(BaF2)��1.84��10-7������������ȫ����ʱ����������Ũ�ȡ�10-5 mol/L����������Ҫ�ķ�����Ũ����___________mol/L����֪![]() ��1.36��������������λ��Ч���֣���
��1.36��������������λ��Ч���֣���
��6��5.0 t��80��BaCO3�ı���ۣ����������������BaCl2��2H2O����___________t ��������2λС����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����nAΪ����٤����������ֵ������˵����ȷ����
A. 23g Na ������H2O��Ӧ��ȫ�������nA��H2����
B. 1 molCu��������Ũ���ᷴӦ������nA��SO3����
C. ��״���£�22.4L N2��H2������к�nA��ԭ��
D. 3mol����Fe��ȫת��ΪFe3O4��ʧȥ8nA������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com