
| A. | 用水鉴别甲酸、乙醛、乙酸 | |
| B. | 除去乙烷中少量的乙烯:光照条件下通入氢气 | |
| C. | 除去乙醇中少量的乙酸:加入足量的生石灰,过滤 | |
| D. | 用燃烧的方法鉴别乙醇、苯和四氯化碳 |
分析 A.甲酸、乙醛、乙酸均溶于水;
B.乙烯与氢气发生加成反应,但乙烷中可引入新杂质氢气;
C.乙酸与CaO反应后,增大与乙醇的沸点差异;
D.乙醇燃烧有淡蓝色火焰,苯燃烧冒黑烟,四氯化碳不能燃烧.
解答 解:A.甲酸、乙醛、乙酸均溶于水,则水不能鉴别,故A错误;
B.乙烯与氢气发生加成反应,但乙烷中可引入新杂质氢气,不能除杂,应选溴水、洗气,故B错误;
C.乙酸与CaO反应后,增大与乙醇的沸点差异,不能过滤,应选蒸馏法分离,故C错误;
D.乙醇燃烧有淡蓝色火焰,苯燃烧冒黑烟,四氯化碳不能燃烧,则燃烧法可鉴别,故D正确;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,把握有机物的性质、物质的鉴别、混合物分离提纯为解答的关键,侧重分析与实验能力的考查,注意有机物性质及实验评价的结合,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡 所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 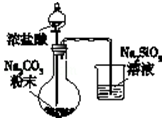 验证酸性:H2CO3>H2SiO3 | |
| B. | 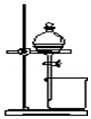 用于分离CCl4萃取碘水后的有机层和水层 | |
| C. | 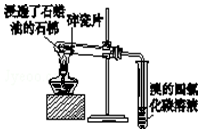 证明石蜡油分解生成的气体是乙烯 | |
| D. | 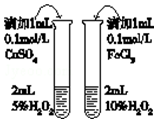 比较不同催化剂对反应速率的影响 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
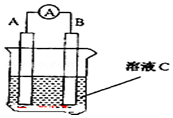 如图原电池装置图:
如图原电池装置图:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
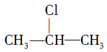 +NaOH$→_{△}^{醇}$CH3-CH═CH2+NaCl+H2O,
+NaOH$→_{△}^{醇}$CH3-CH═CH2+NaCl+H2O,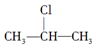 $→_{-NaCl,-H_{2}O}^{NaOH、醇、△}$CH3-CH═CH2下面是几种有机化合物的转化关系:
$→_{-NaCl,-H_{2}O}^{NaOH、醇、△}$CH3-CH═CH2下面是几种有机化合物的转化关系: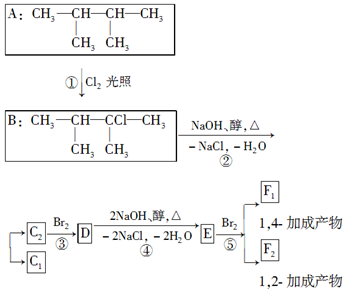
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
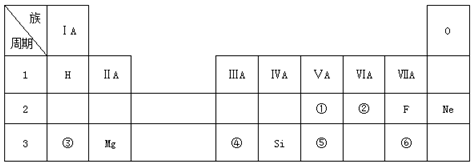
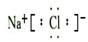 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ③④⑤ | C. | ①④⑤ | D. | ②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
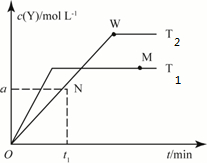 ( )
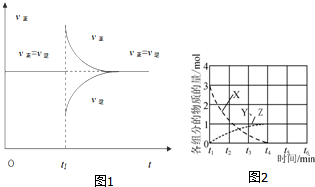
( )| A. | T2下,在0~t1时间内v(X)=$\frac{a}{{t}_{1}}$mol•L-1•min-1 | |
| B. | N点时气体的总压强大于W点时气体的总压强 | |
| C. | M点的正反应速率小于N点的逆反应速率 | |
| D. | W点时再加入一定量Y,平衡后X的转化率减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
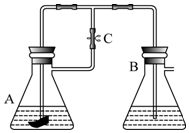 另外还有一种方法制备Fe(OH)2.在如图所示的装置中,用NaOH溶液、铁屑、稀H2SO4等试剂制备.在锥形瓶B中加入的试剂是氢氧化钠溶液.这样生成的Fe(OH)2沉淀也能较长时间保持白色,理由是A中反应生成的氢气,充满了整个实验装置,外界空气不易进入.
另外还有一种方法制备Fe(OH)2.在如图所示的装置中,用NaOH溶液、铁屑、稀H2SO4等试剂制备.在锥形瓶B中加入的试剂是氢氧化钠溶液.这样生成的Fe(OH)2沉淀也能较长时间保持白色,理由是A中反应生成的氢气,充满了整个实验装置,外界空气不易进入.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com