
| A. | 溶液的体积10V甲≤V乙 | |
| B. | 水电离出的OH-浓度:10c(OH-)甲≤c(OH-)乙 | |
| C. | 若分别与5 mL pH=11的NaOH溶液反应,所得溶液的pH:甲≤乙 | |
| D. | 若分别用等浓度的NaOH溶液完全中和,所得溶液的pH:甲≤乙 |
分析 弱酸为弱电解质,存在电离平衡,加水稀释时,促进弱酸的电离;水是弱电解质,存在电离平衡,酸电离产生的氢离子抑制水的电离平衡,据此分析.
解答 解:A.若酸是强酸,则依据溶液稀释过程中氢离子物质的量不变5ml×10-3=V×10-4,解得V=5Oml,则10V甲=V乙,若酸为弱酸,加水稀释时,促进弱酸的电离,电离产生的氢离子增多,要使pH仍然为4,加入的水应该多一些,所以10V甲<V乙,故A正确;
B.pH=3的酸中,氢氧根离子全部有水电离产生,C(OH-)甲=$\frac{{K}_{w}}{c({H}^{+})}$=10-11mol/L,pH=4的酸中,氢氧根离子全部有水电离产生,C(OH-)乙=$\frac{{K}_{w}}{c({H}^{+})}$=10-10mol/L,则10c(OH-)甲=c(OH-)乙,故B错误;
C.若酸是强酸,分别与5mL pH=11的NaOH溶液反应,恰好发生酸碱中和,生成强酸强碱盐,pH值相等,若为弱酸,则反应后酸有剩余,甲中剩余酸浓度大,酸性强,pH小,所得溶液的pH:甲≤乙,故C正确;
D.稀释前后甲乙两个烧杯中所含的一元酸的物质的量相等,依据酸碱中和反应可知,消耗氢氧化钠的物质的量相等,生成的酸盐的浓度甲大于乙,若酸为强酸则二者pH相等,若酸为弱酸,则甲的pH大于乙,故D错误;
故选:AC.
点评 本题考查了弱电解质的电离,酸碱中和的实质,pH的相关计算,题目难度中等,准确理解题意,抓住弱酸存在电离平衡的特点解答.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2017届江西省鹰潭市高三上学期第四次月考化学试卷 题型:选择题
常温下,0.2mol/L的一元酸HA与等浓度的NaOH溶液等体积混合后,所得溶液中都分微粒组分及浓度如图所示,下列说法正确的是

A.HA为强酸
B.该混合液pH=7
C.图中X表示HA,Y表示OH—,Z表示H+
D.该混合溶液中:c(A—)+c(Y)=c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
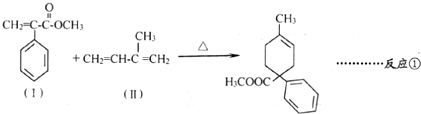
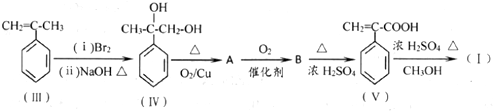
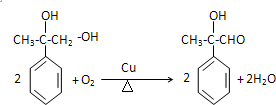 .
. 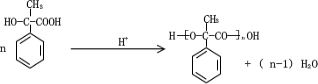 .
.  .
. 和其他无机物叫合成
和其他无机物叫合成 ,最合理的方案
,最合理的方案 $→_{催化剂}^{H_{2}}$
$→_{催化剂}^{H_{2}}$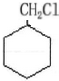 $→_{△}^{NaOH、醇}$
$→_{△}^{NaOH、醇}$ $\stackrel{Cl_{2}}{→}$
$\stackrel{Cl_{2}}{→}$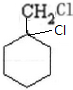
 .
. 查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  三甲苯 三甲苯 | B. | CH3CH(C2H5)CH2CH2CH3 2-乙基戊烷 | ||
| C. | CH3CH(NH2)CH2COOH α-氨基丁酸 | D. | 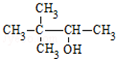 3,3-二甲基-2-丁醇 3,3-二甲基-2-丁醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 对于Si+O2═SiO2,每当新形成2NA个Si-O键,需要断开NA个Si-Si键 | |
| B. | 12.0g熔融的NaHSO4中含有的阳离子数为0.1NA | |
| C. | 次氯酸光照分解产生22.4mL气体(标准状况)转移的电子数为0.002NA | |
| D. | 电解精炼铜时,若阴极析出32g铜,则转移的电子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇、乙二醇、丙三醇互为同系物;H2、D2、T2互为同素异形体 | |
| B. | 绿矾、碱石灰、苏打、干冰分别属于纯净物、混合物、电解质、非电解质 | |
| C. | 乙烯水化、铁铝钝化、植物油氢化、纯碱晶体风化等过程中都包含化学变化 | |
| D. | 蛋白质、纤维素、硝化纤维等都是高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去NaHCO3溶液中少量的Na2CO3:加入适量稀盐酸 | |
| B. | 除去FeCl2溶液中少量的FeCl3:加入稍过量铁粉,过滤 | |
| C. | 除去NH4Cl固体中少量I2:加热,I2升华除去 | |
| D. | 除去乙烯中的少量SO2:通过酸性KMnO4溶液,洗液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
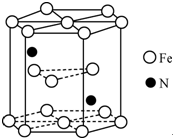 铁及其化合物在生产生活及科学研究方面应用非常广泛.
铁及其化合物在生产生活及科学研究方面应用非常广泛. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com