
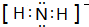 .
. 分析 A、B、C、D为短周期元素,B、A可形成两种液态化合物,其原子个数比分别为1:1和2:1,且分子中电子总数分别为18和10,则A为O元素、B为H元素;B与D能形成一种极易溶于水的碱性气体X,X分子与H2O分子中的电子数相同,则D为N元素,X为NH3;B与C能形成一种极易溶于水的酸性气体Y,Y分子中的电子数为18,则C为Cl,Y为HCl;A、B、D形成离子化合物B4A3D2为NH4NO3,溶液中铵根离子水解呈弱酸性,据此解答.
解答 解:A、B、C、D为短周期元素,B、A可形成两种液态化合物,其原子个数比分别为1:1和2:1,且分子中电子总数分别为18和10,则A为O元素、B为H元素;B与D能形成一种极易溶于水的碱性气体X,X分子与H2O分子中的电子数相同,则D为N元素,X为NH3;B与C能形成一种极易溶于水的酸性气体Y,Y分子中的电子数为18,则C为Cl,Y为HCl;A、B、D形成离子化合物B4A3D2为NH4NO3,溶液中铵根离子水解呈弱酸性.
(1)O元素的不同原子有16O、18O,B为氢元素,H原子核外有1个电子,占据了1个轨道,
故答案为:16O、18O;1;
(2)C为Cl元素,原子核外最外层的电子排布式为3s23p5,Cl2和过量NH3反应的化学方程式:3Cl2+8NH3=N2+6NH4Cl,每生成1mol氮气,转移的电子物质的量为1mol×6=6mol,
故答案为:3s23p5;3Cl2+8NH3=N2+6NH4Cl;6;
(3)N2分子之间形成N≡N三键,键能大,化学性质稳定,
故答案为:含有N≡N,键能大;
(4)B4A3D2为NH4NO3,所含的化学键有:离子键、共价键,其水溶液中铵根离子水解,溶液呈酸性,各离子浓度大小顺序为:NO3->NH4+>H+>OH-,
故答案为:离子键、共价键;NO3->NH4+>H+>OH-;
(5)液态NH3能自身电离:2NH3?NH4++NH2-,其阴离子电子式为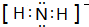 ,
,
故答案为: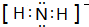 .
.
点评 本题考查元素化合物推断、盐类水解、核外电子排布、化学键、电子式等,推断元素是解题关键,难度中等.


 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | SO2和SO3都是酸性氧性物,二者的水溶液都是强酸 | |
| B. | 将足量的SO2通入BaCl2溶液中可生成白色沉淀 | |
| C. | 检验SO2中是否含有CO2的方法是通过澄清的石灰水 | |
| D. | 向含有BaCl2和NaOH的混合溶液中通入少量SO2气体,有白色沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 青蒿素可溶于乙醚和水 | |
| B. | 青蒿素的晶体为分子晶体,化学式为C16H20O5 | |
| C. | 青蒿素与NaOH溶液不反应 | |
| D. | 青蒿素含有过氧键,一定条件下有氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通入足量的二氧化碳后的溶液中Na+、$Al{O_2}^-、$$CH_3^{\;}CO{O^-}、$$C{O_3}^{2-}$ | |
| B. | 无色溶液中$M{g^{2+}}、Mn{O_4}^-、S{O_4}^{2-}、{I^-}$ | |
| C. | 酸性溶液中可能大量存在 $N{a^+}、Cl{O^-}、S{O_4}^{2-}、{I^-}$ | |
| D. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1012的溶液中$N{H_4}^+、C{l^-}$、Al3+、$N{O_3}^-$ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com