
| 催化剂(MnO2) | 操作情况 | 观察结果 | 反应完成所需的时间 |
| 粉末状 | 混合不振荡 | 剧烈反应,使木条复燃 | 3.5分钟 |
| 块状 | | 反应较慢,火星红亮但木条未复燃 | 30分钟 |
| 双氧水体积 | 操作情况 | 反应完成所需的时间 | 收集到气体体积 | 反应后液体温度 |
| a1%的150mL | | 11分钟 | 539mL | 24℃ |
| a2%的15mL | 混合不振荡 | 1分20秒 | 553mL | 56℃ |
| a3%的7.5mL | | 9秒 | 562mL | 67℃ |
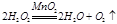
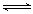 HO2-+H+(H2O2
HO2-+H+(H2O2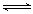 HOO-+H+)
HOO-+H+)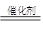 2H2O+O2↑。
2H2O+O2↑。 HO2-+H+(H2O2
HO2-+H+(H2O2 HOO-+H+)。
HOO-+H+)。

 小学教材全测系列答案
小学教材全测系列答案科目:高中化学 来源:不详 题型:单选题
| A.氨气和HCl气体混合生成NH4Cl固体 | B.氨的催化氧化 |
| C.工业上用N2和H2 合成氨 | D.NO遇到空气变为红棕色 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
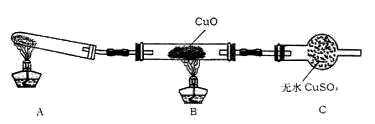
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
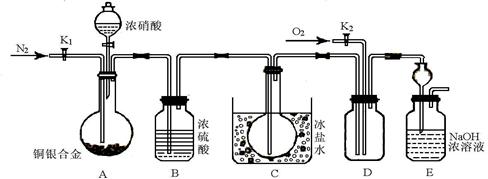
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
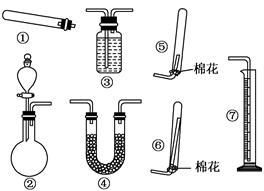
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
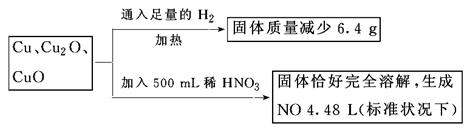
| A.3.2 mol·L- | B.3.6 mol·L-1 | C.4.0 mol·L-1 | D.4.4mol·L-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.a=4b+3c | B.a=4b+c | C.a:b=4:1 | D.a:b=4:3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com