
现有0.1 mol·L-1氨水10 mL,加蒸馏水稀释到1 L后,下列变化中正确的是( )
①电离程度增大;②c(NH3·H2O)增大;③N 数目增多;④c(OH-)增大;⑤导电性增强;⑥
数目增多;④c(OH-)增大;⑤导电性增强;⑥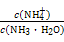 增大
增大
A.①②③ B.①③⑤ C.①③⑥ D.②④⑥
科目:高中化学 来源:2014高考化学二轮专题突破 专题三溶液组成的计量及其应用练习卷(解析版) 题型:填空题
盐泥是氯碱工业中的废渣,主要成分是镁的硅酸盐和碳酸盐(含少量铁、铝、钙的盐)。实验室以盐泥为原料制取MgSO4·7H2O的实验过程如下:
―→―→产品
已知:①室温下Ksp[Mg(OH)2]=6.0×10-12。②在溶液中,Fe2+、Fe3+、Al3+从开始沉淀到沉淀完全的pH范围依次为7.1~9.6、2.0~3.7、3.1~4.7。③三种化合物的溶解度(S)随温度变化的曲线如图所示。

(1)在盐泥中加入稀硫酸调pH为1~2以及煮沸的目的是_____________________。
(2)若室温下的溶液中Mg2+的浓度为6.0 mol·L-1,则溶液pH≥________才可能产生Mg(OH)2沉淀。
(3)由滤液Ⅰ到滤液Ⅱ需先加入NaClO调溶液pH约为5,再趁热过滤,则趁热过滤的目的是__________________,滤渣的主要成分是______________________。
(4)从滤液Ⅱ中获得MgSO4·7H2O晶体的实验步骤依次为①向滤液Ⅱ中加入______________;②过滤,得沉淀;③________________;④蒸发浓缩,降温结晶;⑤过滤、洗涤得产品。
(5)若获得的MgSO4·7H2O的质量为24.6 g,则该盐泥中镁[以Mg(OH)2计]的百分含量约为________(MgSO4·7H2O的相对分子质量为246)。
查看答案和解析>>
科目:高中化学 来源:2014高考化学专题突破训练 专题8电化学原理练习卷(解析版) 题型:选择题
用酸性氢氧燃料电池为电源进行电解的实验装置图如图所示,下列说法中正确的是( )
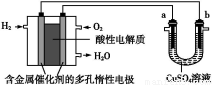
A.燃料电池工作时,正极反应为:O2+2H2O+4e-=4OH-
B.a极是铁,b极是铜时,b极逐渐溶解,a极上有铜析出
C.a极是粗铜,b极是纯铜时,a极逐渐溶解,b极上有铜析出
D.a、b两极均是石墨时,在相同条件下a极产生的气体与电池中消耗的H2体积相等
查看答案和解析>>
科目:高中化学 来源:2014高考化学专题突破训练 专题7电解质溶液练习卷(解析版) 题型:填空题
已知H2A在水中存在以下平衡:H2A H++HA-,HA-
H++HA-,HA- H++A2-。回答以下问题:
H++A2-。回答以下问题:
(1)NaHA溶液 (填“显酸性”、“显碱性”、“显中性”或“酸碱性无法确定”)。
(2)某温度下,若向0.1 mol/L的NaHA溶液中滴入0.1 mol/L KOH溶液使混合溶液中c(H+)=c(OH-),则此时该混合溶液中,下列关系一定正确的是 (填字母)。
A.c(H+)·c(OH-)=1×10-14
B.c(Na+)+c(K+)=c(HA-)+2c(A2-)
C.c(Na+)>c(K+)
D.c(Na+)+c(K+)=0.05 mol/L
(3)已知常温下H2A的钙盐(CaA)饱和溶液中存在以下平衡:CaA(s) Ca2+(aq)+A2-(aq) ΔH>0
Ca2+(aq)+A2-(aq) ΔH>0
①温度升高时,Ksp (填“增大”、“减小”或“不变”,下同)。
②滴加少量浓盐酸,c(Ca2+) 。
(4)若向CaA悬浊液中加入CuSO4溶液,生成一种黑色固体物质,写出该过程中反应的离子方程式: 。
查看答案和解析>>
科目:高中化学 来源:2014高考化学专题突破训练 专题6化学反应速率和化学平衡练习卷(解析版) 题型:填空题
一定温度下,向一容积为5 L的恒容密闭容器中充入0.4 mol SO2和0.2 mol O2,发生反应:2SO2(g)+O2(g) 2SO3(g) ΔH=-196 kJ·mol-1。当反应达到平衡时,容器内压强变为起始时的0.7倍。请回答下列问题:
2SO3(g) ΔH=-196 kJ·mol-1。当反应达到平衡时,容器内压强变为起始时的0.7倍。请回答下列问题:
(1)判断该反应达到平衡状态的标志是 (填字母)。
a.SO2、O2、SO3三者的浓度之比为2∶1∶2
b.容器内气体的压强不变
c.容器内混合气体的密度保持不变
d.SO3的物质的量不再变化
e.SO2的生成速率和SO3的生成速率相等
(2)①SO2的转化率为 ;②达到平衡时反应放出的热量为 ;③此温度下该反应的平衡常数K= 。
(3)如图表示平衡时SO2的体积分数随压强和温度变化的曲线,则:
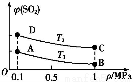
①温度关系:T1 T2(填“>”、“<”或“=”,下同);
②平衡常数关系:KA KB,KA KD。
查看答案和解析>>
科目:高中化学 来源:2014高考化学专题突破训练 专题6化学反应速率和化学平衡练习卷(解析版) 题型:选择题
为减小CO2对环境的影响,在倡导“低碳”的同时,还需加强对CO2创新利用的研究。T1 ℃时,将9 mol CO2 和12 mol H2充入3 L密闭容器中,发生反应CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH<0,容器中CH3OH的物质的量随时间变化如曲线Ⅰ所示,平衡时容器内压强为p1。改变某一条件重新进行上述反应,CH3OH的物质的量随时间变化如曲线Ⅱ所示。下列说法错误的是( )
CH3OH(g)+H2O(g) ΔH<0,容器中CH3OH的物质的量随时间变化如曲线Ⅰ所示,平衡时容器内压强为p1。改变某一条件重新进行上述反应,CH3OH的物质的量随时间变化如曲线Ⅱ所示。下列说法错误的是( )

A.曲线Ⅱ对应的条件改变是增大压强
B.T2℃时,上述反应平衡常数为0.42,则T2>T1
C.在T1℃,若起始时向容器中充入5 mol CO2、5 mol H2、5 mol CH3OH(g)和5 mol H2O(g),则达平衡前v(正)>v(逆)
D.在T1℃,若起始时向容器充入4.5 mol CO2、6 mol H2,平衡时容器内压强p=
查看答案和解析>>
科目:高中化学 来源:2014高考化学专题突破训练 专题4化学反应中的能量变化练习卷(解析版) 题型:填空题
(1)新的《环境空气质量标准》(GB 3095 2012)将于2016年1月1日在我国全面实施。据此,环境空气质量指数(AQI)日报和实时报告包括了SO2、NO2、CO、O3、PM10、PM2.5等指标,为公众提供健康指引,引导当地居民合理安排出行和生活。
2012)将于2016年1月1日在我国全面实施。据此,环境空气质量指数(AQI)日报和实时报告包括了SO2、NO2、CO、O3、PM10、PM2.5等指标,为公众提供健康指引,引导当地居民合理安排出行和生活。
①汽车排出的尾气中含有CO和NO等气体,用化学方程式解释产生NO的原因 。
②汽车排气管内安装的催化转化器,可使汽车尾气中的主要污染物转化为无毒的大气循环物质。已知:
N2(g)+O2(g)=2NO(g) ΔH=+180.5 kJ/mol
2C(s)+O2(g)=2CO(g) ΔH=-221.0 kJ/mol
C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ/mol
则反应2NO(g)+2CO(g)=N2(g)+2CO2(g)的ΔH= kJ/mol。
(2)直接排放氮氧化物会形成酸雨、雾霾,催化还原法和氧化吸收法是常用的处理方法。利用NH3和CH4等气体除去烟气中的氮氧化物。已知:CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH1=a kJ/mol;欲计算反应CH4(g)+4NO(g)=CO2(g)+2H2O(l)+2N2(g)的焓变ΔH2则还需要查询某反应的焓变ΔH3,当反应中各物质的化学计量数之比为最简整数比时,ΔH3=b kJ/mol,该反应的热化学方程式是 ,据此计算出ΔH2= kJ/mol(用含a、b的式子表示)。
(3)下表列出了工业上吸收SO2的三种方法。
方法Ⅰ | 用氨水将SO2转化(NH4)2SO3,再氧化成(NH4)2SO4 |
方法Ⅱ | 用生物质热解气(主要成分CO、CH4、H2)将SO2在高温下还原成单质硫 |
方法Ⅲ | 用Na2SO3溶液吸收SO2,再经电解转化为H2SO4 |
方法Ⅱ主要发生了下列反应:
2CO(g)+SO2(g)=S(g)+2CO2(g) ΔH=+8.0 kJ/mol
2H2(g)+SO2(g)=S(g)+2H2O(g)ΔH=+90.4 kJ/mol
2CO(g)+O2(g)=2CO2(g) ΔH=-566.0 kJ/mol
2H2(g)+O2(g)=2H2O(g) ΔH=-483.6 kJ/mol
则S(g)与O2(g)反应生成SO2(g)的热化学方程式可表示为 。
(4)合成氨用的氢气可以甲烷为原料制得。有关化学反应的能量变化如图所示,则CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式为 。

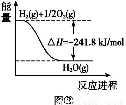
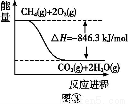
查看答案和解析>>
科目:高中化学 来源:2014高考化学专题突破训练 专题1物质的组成性质分类和化学用语练习卷(解析版) 题型:选择题
下列化学用语中,书写错误的是( )
A.硫离子的结构示意图:
B.氟化钠的电子式:Na+[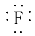 ]-
]-
C.甲基的电子式: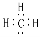
D.次氯酸的结构式:H—O—Cl
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com