
| A. | 该反应属于复分解反应 | B. | 该反应中Cl2是还原剂 | ||
| C. | 该反应中NH3发生还原反应 | D. | 该反应生成1molN2有6mol电子转移 |
分析 3Cl2+2NH3=N2+6HCl中,Cl元素的化合价有0降低为-1价,N元素的化合价有-3价升高为0,该反应中转移6e-,以此来解答.
解答 解:A.反应物、生成物中均有单质,存在化合价的变化属于氧化还原反应,则不属于复分解反应,故A错误;
B.3Cl2+8NH3═N2+6NH4Cl中,Cl元素的化合价有0降低为-1价,Cl2是氧化剂,故B错误;
C.反应中N元素的化合价有-3价升高为0,则NH3被氧化,发生氧化反应,故C错误;
D.生成1molN2,只有2molNH3作还原剂,有2mol×3=6mol电子转移,故D正确;
故选D.
点评 本题考查氧化还原反应,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念的考查,注意分析元素的化合价,题目难度不大.


 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 2.3Na与O2完全反应生成3.6g产物时失去电子数为0.1NA | |
| B. | 电解精炼铜时,当电路中转移NA个电子,阳极溶解32g铜 | |
| C. | 标准状况下,11.2LSO3中所含原子数为2NA | |
| D. | 5.6g铁粉与稀硝酸反应失去的电子数一定为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
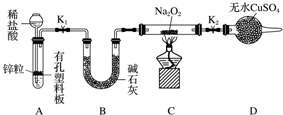 Na2O2可用作漂白剂和呼吸面具中的供氧剂.
Na2O2可用作漂白剂和呼吸面具中的供氧剂.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二者阴阳离子个数之比都为2:1 | |
| B. | 二者都能与CO2发生化合反应生成Na2CO3 | |
| C. | 二者都是强氧化剂 | |
| D. | 1molNa2O2与足量盐酸反应,转移电子的物质的量为2mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
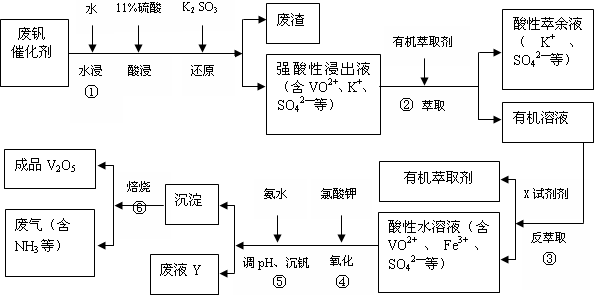
| pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
| 钒沉淀率/% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.8 | 96.4 | 93.1 | 89.3 |
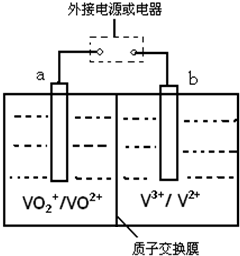
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 括号内为杂质 | 除杂试剂 | 除杂操作 |
| A | Fe(Al)粉 | NaOH溶液 | 在过量的NaOH溶液中充分反应后过滤 |
| B | Na2O2(Na2O)固体 | O2 | 在纯氧气中加热 |
| C | FeCl2(FeCl3)溶液 | Fe粉 | 加入过量Fe粉,充分反应后过滤 |
| D | Na2CO3(NaHCO3) 溶液 | CO2 | 通入过量的CO2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下6.5g Zn与足量浓盐酸反应生成H2的分子数为0.1NA | |
| B. | 标准状况下,2.24L NH3所含电子数为NA | |
| C. | 500mL 1mol•L-1的K2SO4溶液中含有K+数目为NA | |
| D. | 1mol NH3溶于水后所得氨水中,OH-的数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  热化学方程式是H2(g)+$\frac{1}{2}$O2(g)=H2O(g) DH=-241.8 kJ/mol | |
| B. | 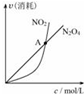 对于恒温恒容条件下的反应2NO2(g)?N2O4(g),A点为平衡状态 | |
| C. | 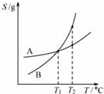 将A、B饱和溶液分别由T1℃升温至T2℃时,溶质的质量分数B>A | |
| D. |  HA的酸性强于HB |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 时间/s | 0 | 500 | 100 0 | 150 0 |
| c(N2O5)/mol•L-1 | 5.00 | 3.52 | 2.50 | 2.50 |
| A. | 500s内N2O5分解速率为2.96×10-3mol•L-1•s-1 | |
| B. | T1温度下的平衡常数为K1=125,平衡时N2O5的转化率为50% | |
| C. | 达平衡后其他条件不变,将容器的体积压缩到原来的1/2,则平衡时c(N2O5)>5.00mol•L-1 | |
| D. | T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K1<K2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com