
����Ŀ�������̿�ۣ���Ҫ����MnO2��������������Fe2O3��Al2O3�����ʣ�Ϊԭ���Ʊ��ߴ�MnO2����������ͼ��ʾ��

��֪���ٳ����£�Ksp[Fe(OH)3]=8.0��10-38��Ksp [Al(OH)3]=4.0��10-34��
�ڳ����£��������������������Al3+��Fe3+��ȫ������pH�ֱ�Ϊ4.6��3.4��Mn2+��ʼ������pHΪ8.1��
�۳����£�����Һ�н����������ʵ���Ũ��С�ڻ����1��10-5mol��L-lʱ������Ϊ�ý��������ѱ�������ȫ��
��1�� �������ʱ����һ���������ᣬ����ܹ������١������ᡱ������ɰ�����ʧ���������ʱ���������ʱ���к��ɫ�����֣�ԭ����________________________��
��2�����백ˮӦ����pH�ķ�ΧΪ__________________����Fe3+ǡ�ó�����ȫʱ��c(Al3+)=_____________mol��L-l��
��3�������ˡ���������ΪMnCO3����Һ�����ʵ���Ҫ�ɷ���____________���ѧʽ����д���������ӵĵ���ʽ��_______________________________��
��4������̼����鱗��������Ĺ��̳�Ϊ�����̡���
�١����̡������зų�CO2����Ӧ�����ӷ���ʽΪ_______________________________��
�ڡ����̡������г����������¶ȵĹ�ϵ��ͼ��ʾ�����¶ȸ���60��ʱ���������������¶����߶�������ԭ�������________________________________________________��

��5����ҵ�ϲ��ü��������ԭ�ζ����ⶨMnO2���ȣ�������������£�ȷ����0.9200g����Ʒ������������KI��Һ��ַ�Ӧ�����Ƴ�100mL��Һ��ȡ����20.00mL��ǡ����25.00mL 0.0800mol��L-1 Na2S2O3��Һ��Ӧ��I2+2S2O32-=2I-+S4O62-��������ɵø���Ʒ����Ϊ___________��
���𰸡����ɵ�Fe3+ˮ��õ�Fe(OH)3����4.6~8.10.05(NH4)2SO4 Mn2++2HCO3-=MnCO3��+CO2��+H2O�¶ȹ���ʱ̼����淋ķֽ����������ӿ죬����������̼�����Ũ�ȵļ�С������47.3%
Mn2++2HCO3-=MnCO3��+CO2��+H2O�¶ȹ���ʱ̼����淋ķֽ����������ӿ죬����������̼�����Ũ�ȵļ�С������47.3%
��������
��1���������ʱ���������ʱ���к��ɫ�����֣�ԭ�������ɵ�Fe3+ˮ��õ�Fe(OH)3�������ʴ�Ϊ�����ɵ�Fe3+ˮ��õ�Fe(OH)3������
��2����������Ϣ��֪��Al3+��Fe3+��ȫ������pH�ֱ�Ϊ4.6��3.4��Mn2+��ʼ������pHΪ8.1�����ԣ����백ˮӦ����pH�ķ�ΧΪ4.6~8.1����Fe3+ǡ�ó�����ȫʱ�������ʵ���Ũ�����ֵΪ1��10-5mol��L-l����ʱ��Һ��c(OH-)����СֵΪ![]() mol/L��c(Al3+)=
mol/L��c(Al3+)=![]() 0.05mol��L-l���ʴ�Ϊ��4.6~8.1��0.05��
0.05mol��L-l���ʴ�Ϊ��4.6~8.1��0.05��
��3������������������ΪMnCO3����Һ�����ʵ���Ҫ�ɷ���(NH4)2SO4���������ӵĵ���ʽΪ![]() ���ʴ�Ϊ��(NH4)2SO4��
���ʴ�Ϊ��(NH4)2SO4��![]() ��
��
��4�����������������зų�CO2����Ӧ�����ӷ���ʽΪMn2++2HCO3-=MnCO3��+CO2��+H2O���ʴ�Ϊ��Mn2++2HCO3-=MnCO3��+CO2��+H2O��
�ڵ��¶ȸ���60��ʱ���������������¶����߶�������ԭ������ǣ��¶ȹ���ʱ̼����淋ķֽ����������ӿ죬����������̼�����Ũ�ȵļ�С��������
��5���ɷ�Ӧ���̿ɵõ���ϵʽ��
MnO2��I2��2S2O32-
1 2
n0.02500L��0.0800molL-1��![]()
n=0.005mol�� ����ƷMnO2����=![]() ��100%=47.3%���ʴ�Ϊ��47.3%��
��100%=47.3%���ʴ�Ϊ��47.3%��


 ��ս�п�����ϵ�д�
��ս�п�����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����г������ʵ������뻯ѧʽ��Ӧ��ȷ����(����)
A.â����BaSO4B.ʯӢ��Na2SiO3
C.�մ�Na2CO3D.����ʯ��Al2O3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ���ǣ� ��
A.H216O��H218O����ͬλ��
B.��ͬ�����CO2��NO2������ͬ�ķ�����
C.NaCl��Һ�ܵ��磬����NaCl��Һ�ǵ����
D.������Һʱ������ƿ��ԭ������������ˮ����Ӱ��ʵ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ȥ����þ�е���������������ѡ��(����)
A.ˮB.����
C.��ˮD.����������Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ�Dz��ֶ�����Ԫ�صĵ��ʼ��仯�������Һ����ת����ϵ����֪����B2��C2��D2��E2�ڳ��³�ѹ�¶������壬������G����ɫ��ӦΪ��ɫ��������I��J��Kͨ��״���³���̬������˵����ȷ����
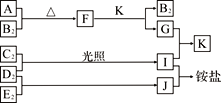
A. B�⻯��ķе������ͬ��������Ԫ���⻯��ķе�
B. ԭ�Ӱ뾶��С��A��C��B��E��D
C. F�мȺ������Ӽ��ֺ��м��Թ��ۼ�
D. G�е�������������ˮ�ĵ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
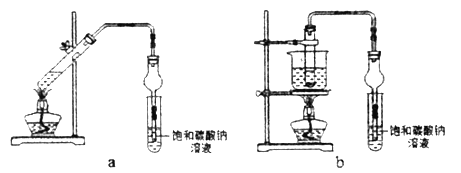
����Ŀ����������(�׳��Ȼ�������SOCl2)��һ��Һ̬������е�77�棬��ũҩ����ҩ��ҵ���л��ϳɵ�������;�㷺��ʵ���Һϳ�ԭ����SO2+Cl2+SCl2=2SOCl2������װ����ͼ��ʾ��

��ش��������⣺
��1������c��������__________________
��2��ʵ�����ö���������Ũ���Ṳ�ȷ�Ӧ�����ӷ���ʽΪ_______________________
��3����֪SOCl2��ˮ���ҷ�Ӧ��Һ���ϲ��������������д̼�����ζ���������������AlCl3��Һ���ܵõ���ˮAlCl3��ʹSOCl2��AlCl3��6H2O��ϼ��ȣ��ɵõ���ˮAlCl3���Խ���ԭ��_______________________________________________________
��4)װ��e�в�����Cl2����װ��d��������ϴ��ƿ�������������ƿ����Cl2������һ��ϴ��ƿӦ������Լ���__________
��5������Ӧ������Cl2�����Ϊ896 mL(��ת��Ϊ��״����SO2����)�����õ�������SOCl2 4.76 g����SOCl2�IJ���Ϊ__________��������λ��Ч���֣���
��6�������������õ�SOCl2�м�������NaOH��Һ�������õõ���ɫ��ҺW��������ҺW�д���Cl-�ķ�����________________________________________________________________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±���Ԫ�ؾ��ڱ���һ���֣������Ҫ�����

(1) Ԫ�آ��������_____�����ӣ��ڻ������е�������ϼ�Ϊ________��
(2) Ԫ�آ��γɵ����ӵĽṹ����ͼΪ_________��
(3) �õ���ʽ��ʾԪ�آٺ͢���ɵĻ�������γɹ��̣�_______________��
(4) Ԫ�آܡ��ݵ�����������ˮ����֮�䷢����Ӧ�����ӷ���ʽ______________ ��
(5) ����ѡ������֤��Ԫ�آߵķǽ�����ǿ��Ԫ�آ���________��˫ѡ����
A��H2S����������HCl B��S2-�Ļ�ԭ��ǿ��C1-
C��H2SO3������ǿ��HClO D��H2S����HC1�ȶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������㷺����ҩ�Ⱦ�ϡ����ϵȹ�ҵ��ijѧϰС�������������װ�����Ҵ��������Ũ����ֱ��Ʊ������������е�77.2�棩������˵������ȷ����
A. Ũ�����ܼӿ�������Ӧ���� B. �������������ή�������
C. װ��b��װ��aԭ����ʧ���� D. ���÷�Һ�ķ����������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڳ��¡���ѹ���������£�N2�ڴ���������H2O������Ӧ��2N2(g)+6H2O(l) =4NH3(g)+3O2(g)����2 L���ܱ������У���ʼ��Ӧ��������ͬ��������ʹ�����Ҳ��ͬ�����Ʋ�ͬ�¶ȷֱ����4��ʵ�飬3 h��ⶨNH3���������������������±���
ʵ�鼶�� | ʵ��1 | ʵ��2 | ʵ��3 | ʵ��4 |
�¶�/K | 303 | 313 | 323 | 353 |
NH3������/106mol | 4.8 | 5.9 | 6.0 | 2.0 |
����˵������ȷ����
A. �¶�Ϊ303 Kʱ����3 h���õ�����ʾ��ƽ����Ӧ����Ϊ4��107mol��L1��h1
B. ʵ��1��ʵ��3�У�3 h��N2��ת����֮��Ϊ4:5
C. ��������ʵ�����ݿɵó����¶����߿ɼӿ췴Ӧ���ʣ�Ҳ���ܼ�����Ӧ����
D. 353 Kʱ�������Ǵ����������½���ˮ����������棬��ʹ��ѧ��Ӧ���ʼ���
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com