
【题目】某探究学习小组用如图所示装置进行SO2、Fe2+和Cl-还原性强弱比较实验,实验过程如下:
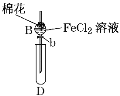
Ⅰ.先向B中的FeCl2溶液(约10mL)中通入Cl2,当B中溶液变黄时,停止通气。
Ⅱ.打开活塞b,使约2mL的溶液流入D试管中,检验取出溶液中的离子。
Ⅲ.接着再向B中通入一定量的SO2气体。
Ⅳ.更新试管D,重复过程Ⅱ,检验取出溶液中的离子。
(1)棉花中浸润的溶液为____________,目的是________________。
(2)实验室制备氯气的化学方程式为______________________。
(3)过程Ⅲ中一定发生反应的离子方程式为______________________,过程Ⅳ中检验取出溶液中是否含有硫酸根的操作是_____________________。
(4)该小组对SO2、Fe2+和Cl-还原性强弱比较期望达到的结论是_______________。
(5)甲、乙、丙三同学分别完成了上述实验,下表是他们的检测结果,他们的检测结果一定能够证明SO2、Fe2+和Cl-还原性强弱关系的是______________。
过程Ⅱ中检出离子 | 过程Ⅳ中检出离子 | |
甲 | 有Fe3+无Fe2+ | 有SO42- |
乙 | 既有Fe3+又有Fe2+ | 有SO42- |
丙 | 有Fe3+无Fe2+ | 有Fe2+ |
【答案】NaOH溶液防止尾气污染环境MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O2Fe3++SO2+2H2O===2Fe2++SO42-+4H+取溶液少许于试管中,先加入足量稀盐酸酸化,再滴加少量BaCl2溶液,若有白色沉淀生成,证明有SO42-,反之无SO42-SO2>Fe2+>Cl-乙丙
MnCl2+Cl2↑+2H2O2Fe3++SO2+2H2O===2Fe2++SO42-+4H+取溶液少许于试管中,先加入足量稀盐酸酸化,再滴加少量BaCl2溶液,若有白色沉淀生成,证明有SO42-,反之无SO42-SO2>Fe2+>Cl-乙丙
【解析】
Ⅰ.先向B中的FeCl2溶液(约10ml)中通入Cl2,当B的溶液变黄时,则氯气将二价铁氧化成三价铁时,停止通气;
Ⅱ.打开活塞b,使约2ml的溶液流入D试管中,用KSCN溶液来检验溶液中的三价铁离子;
Ⅲ.接着再向B中通入一定量的SO2气体,还原三价铁,生成二价铁和硫酸根;
Ⅳ.更新试管D,重复过程Ⅱ,用先加入足量稀盐酸酸化,再滴加少量BaCl2溶液,来检验有SO42-;据此分析解答。
(1)氯气和二氧化硫都是气体且有毒,实验过程中要防止氯气和二氧化硫逸出而污染空气,二者都能和NaOH溶液反应产生无毒物质,所以可以用NaOH溶液吸收两种气体,故答案为:NaOH溶液;防止尾气污染环境;
(2)加热条件下,浓盐酸和二氧化锰发生氧化还原反应生成氯气、氯化锰和水,离子方程式为MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,故答案为:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O,故答案为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O;
MnCl2+Cl2↑+2H2O;
(3)二氧化硫具有还原性,能和铁离子发生氧化还原反应生成硫酸根离子、亚铁离子和氢离子,离子方程式为2Fe3++SO2+2H2O═2Fe2++SO42-+4H+;实验室用盐酸酸化的氯化钡溶液检验硫酸根离子,其检验方法为取溶液少许于试管中,先加入足量稀盐酸酸化,再滴加少量BaCl2溶液,若有白色沉淀生成,证明有SO42-,反之无SO42-,故答案为:2Fe3++SO2+2H2O═2Fe2++SO42-+4H+;取溶液少许于试管中,先加入足量稀盐酸酸化,再滴加少量BaCl2溶液,若有白色沉淀生成,证明有SO42-,反之无SO42-;
(4)该题的理论依据是氧化还原反应中还原剂的还原性大于还原产物,该小组对SO2、Fe2+和Cl-还原性强弱比较期望达到的结论是SO2>Fe2+>Cl-,故答案为:SO2>Fe2+>Cl-;
(5)乙中第一次,说明氯气不足,氯气氧化性大于铁离子,第二次有硫酸根离子,说明发生二氧化硫与铁离子的反应,则氧化性铁离子大于二氧化硫,丙中第一次有Fe3+,无Fe2+,则氯气的氧化性大于铁离子,第二次有亚铁离子,说明发生二氧化硫与铁离子的反应,则氧化性铁离子大于二氧化硫,所以一定能够证明SO2、Fe2+和Cl-还原性强弱关系的是乙、丙,故答案为:乙、丙。


科目:高中化学 来源: 题型:
【题目】已知:pKa=-lgKa,25 ℃时,H2SO3 的 pKa1=1.85,pKa2=7.19。常温下,用 0.1 mol·L-1NaOH 溶液滴定 20 mL0.1 mol·L-1H2SO3 溶液的滴定曲线如右图所示。 下列说法不正确的是( )
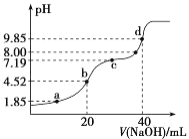
A. a 点所得溶液中:c(HSO3-)=c(H2SO3)
B. b 点所得溶液中:c(H2SO3)+c(H+)=c(SO32-)+c(OH-)
C. c 点所得溶液中:c(Na+)=3c(HSO3-)
D. d 点所得溶液中:c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
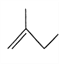
【题目】有机物的结构简式可进一步简化,如:
CH3CH2CH2CH3: 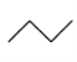 ,
,![]() :
: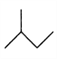 ,CH3CH=CHCH3 :
,CH3CH=CHCH3 :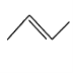
(1)写出下列有机物的结构简式:
2,2,3,3-四甲基戊烷:____________________;
3,4-二甲基-4-乙基庚烷:____________________。
(2)写出下列物质的分子式:
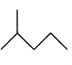 :__________________________;
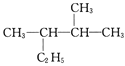
:__________________________; :__________________________。
:__________________________。
(3)用系统命名法命名下列物质:
![]() ____________________。
____________________。
 ____________________。
____________________。
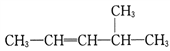 ____________________。
____________________。
![]() ____________________。
____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示晶体结构是一种具有优良的电压、电光等功能的晶体材料的最小结构单元(晶胞).晶体内与每个“Ti”紧邻的氧原子数和这种晶体材料的化学式分别是(各元素所带电荷均已略去)( )
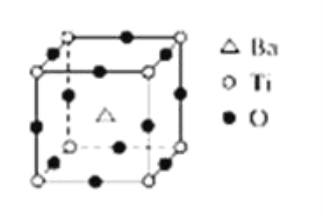
A. 8;BaTi8O12
B. 8;BaTi4O9
C. 6;BaTiO3
D. 3;BaTi2O3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟利昂是饱和碳氢化台物的卤族衍生物的总称,其破坏臭氧层的化学反应机理如下[以F-12 (二氯二氟甲烷)为例]:
CF2Cl2![]() CF2Cl+Cl
CF2Cl+Cl
Cl+O3→ClO+O2
ClO+ClO→ClOOCl(过氧化氯)
ClOOCl![]() 2Cl+O2
2Cl+O2
下列说法中不正确的是
A. 紫外线可以增大CF2Cl2的分解速率
B. ClO +ClO→ClOOCl的反应中有非极性键的形成
C. CF2Cl2是臭氧破坏反应的催化剂
D. 臭氧屡破坏的关键因素有:氟利昂,太阳光
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素A、B、C、D、E的原子序数依次增大,其元素特征信息如下表:
元素编号 | 元素特征信息 |
A | 最高正价和最低负价的绝对值之差为2 |
B | 原子核电荷数是内层电子数的4倍 |
C | 1molC单质能与冷水反应,在标准状况下生成11.2L H2 |
D | 原子最外层电子数等于其周期序数 |
E | 负二价阴离子的电子层结构与Ar原子相同 |
(1)E的简单离子的结构示意图为____________;
(2)C元素和A元素能化合形成C3A的化合物,该化合物化学式是__________;
(3)C和D简单离子的半径大小为____ >_____;(用离子符号表示)
(4)用两根玻璃棒分别蘸取A元素最高价氧化物对应水化物的浓溶液和A元素的氢化物的浓溶液,相互接近时,可看到大量的白烟,写出产生该现象的化学方程式 _____________________________ 。
(5)元素非金属性强弱比较有很多方法,其中B和E的非金属性强弱的研究方案中可行的是_________(填序号);
a.比较两种单质的颜色 b. 依据两元素在周期表中的位置
c.比较氢化物的稳定性 d.依据两元素单质在自然界中的存在状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中华文化源远流长、博大精深。从化学的视角看,下列理解不正确的是( )
A. “千淘万漉虽辛苦,吹尽黄沙始到金”中“淘”“漉”相当于分离提纯操作中的“过滤”
B. 司母戊鼎属青铜制品,是我国古代科技光辉成就的代表之一
C. 瓷器(China)属硅酸盐产品,China一词又指“瓷器”,这反映了在西方人眼中中国作为“瓷器故乡”的形象
D. 侯德榜是我国化学工业的奠基人,主要成就: 侯氏制碱法,该碱指的是烧碱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素R、X、Y、Z的原子序数依次递增,R的无氧酸溶液能在玻璃容器上刻标记;R和X能形成XR3型化合物,X在化合物中只显一种化合价;R和Z位于同主族,Y原子最外层电子数等于电子层数的2倍。下列有关推断正确的是
A. R单质和Z单质均可与水发生反应置换出O2
B. 上述元素形成的简单离子都能促进水的电离平衡
C. YR6能在氧气中剧烈燃烧
D. 元素对应的简单离子的半径:Y>Z>R>X
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com