
| A. | 在一个基态多电子的原子中,可以有两个运动状态完全相同的电子 | |
| B. | 在一个基态多电子的原子中,不可能有两个能量完全相同的电子 | |
| C. | NF3和BF3是中心原子杂化类型相同的极性分子 | |
| D. | 在SiO2晶体中,Si原子与Si-O键数目比为1:4 |
分析 A.在多电子的原子中,电子填充在不同的能层,能层又分不同的能级,同一能级又有不同的原子轨道,每个轨道中最多可以填充两个电子,自旋相反;
B.每个轨道中最多可以填充两个电子,自旋相反,这两个电子的能量完全相同,另外在等价轨道上填充的电子能量也相同;
C.NF3分子中氮原子含有3个σ键且含有一个孤电子对,杂化类型为sp3,构型为三角锥,结构不对称,BF3分子B原子含有3个σ键且不含孤电子对,杂化类型为sp2,空间构型为平面三角形,结构对称;
D.二氧化硅晶体中存在四面体结构单元,每个硅原子能构成四个共价键,Si处于中心.
解答 解:A.在多电子的原子中,电子填充在不同的能层,能层又分不同的能级,同一能级又有不同的原子轨道,每个轨道中最多可以填充两个电子,自旋相反,在一个基态多电子的原子中,不可能有两个运动状态完全相同的电子,故A错误;
B.每个轨道中最多可以填充两个电子,自旋相反,这两个电子的能量完全相同,另外在等价轨道上填充的电子能量也相同,可能存在能量相同的电子,故B错误;
C.NF3分子中氮原子含有3个σ键且含有一个孤电子对,杂化类型为sp3,构型为三角锥,结构不对称为极性分子,BF3分子B原子含有3个σ键且不含孤电子对,杂化类型为sp2,空间构型为平面三角形,结构对称为非极性分子,故C错误;
D.二氧化硅晶体中存在四面体结构单元,每个硅原子能构成四个共价键,Si处于中心,Si原子与Si-O键数目比为1:4,故D正确;
故选D.
点评 本题考查核外电子排布规律与运动状态、分子空间构型的判断等,难度不大,注意理解核外电子的运动状态的描述.


 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 已知冰的熔化热为6.0 kJ•mol-1,冰中氢键键能为20 kJ•mol-1,假设1 mol 冰中有2 mol氢键,且熔化热完全用于破坏冰的氢键,则最多只能破坏冰中15%的氢键 | |
| B. | 已知一定温度下,醋酸溶液的物质的量浓度为c,电离度为a,电离常数K$\frac{(ca)^{2}}{c(1-a)}$=.若加水稀释,则CH3COOH?CH3C00-+H+向右移动,a增大,Ka不变 | |
| C. | 甲烷的标准燃烧热为-890.3 kjJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH3 (g)+202(g)-C02(g)+2H20(1)△H=-890.3 kJ•mol-1 | |
| D. | 500℃、30 MPa下,将0.5 mol N和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为:N2(g)+3H2(g)$?_{500℃,30MPa}^{催化剂}$2NH3(g)△H=-38.6kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含硫酸的废液倒入水槽,用水冲入下水道 | |
| B. | 金属钠着火燃烧时,用泡沫灭火器灭火 | |
| C. | 少量浓硫酸沾在皮肤上,立即用氢氧化钠溶液冲洗 | |
| D. | 温度计不慎打破,散落的水银应用硫粉处理后收集 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4 | B. | C2H6 | C. | C3H6 | D. | C3H8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
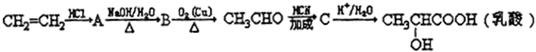
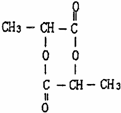 、两分子成链状酯
、两分子成链状酯 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
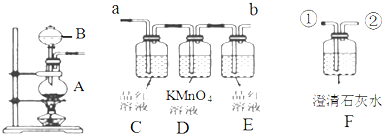
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 20gD2O和18gH2O中含有的质子数均为10NA | |
| B. | 2L0.5mol/L亚硫酸溶液中含有的H+数为2NA | |
| C. | 标准状况下,22.4L水中含有共价键数为2NA | |
| D. | 50mL 12mol/L盐酸与足量MnO2共热,转移的电子数为0.3NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com