
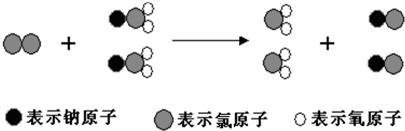
| A. | 该反应的化学方程式为Cl2+2NaClO2═2ClO2+2NaCl | |
| B. | 该反应是应是复分解反应 | |
| C. | 反应中Cl2既是氧化剂,又是还原剂 | |
| D. | NaClO2和ClO2中Cl元素的化合价相同 |
分析 A.由不同小球代表的原子及反应的微观过程来分析,书写反应方程式;
B.复分解反应是化合物与化合物反应生成化合物与化合物的反应;
C.依据化学方程式中氯元素化合价的变化判断,氯气中 氯元素化合价0价变化为-1价;
D.根据化合物中元素化合价代数和为0计算来确定元素的化合价.
解答 解:A.由三种小球表示的原子及微观过程可知,反应物为氯气和NaClO2,生成物为ClO2和NaCl,则反应为Cl2+2NaClO2═2ClO2+2NaCl,故A正确;
B.由不同的小球代表的原子可知,反应物为氯气和NaClO2,氯气为单质,则该反应一定不是复分解反应,故B错误;
C.Cl2+2NaClO2═2ClO2+2NaCl,反应中氯气中 的氯元素化合价0价变化为-1价,NaClO2中氯元素化合价+3价升高到+4价,所以氯气做氧化剂,故C错误;
D.根据化合价规则,NaClO2和ClO2中Cl的化合价分别是+3价和+4价,化合价不一样,故D错误;
故选A.
点评 本题考查氧化还原反应及反应的微观过程的认识,明确反应的分类及常见元素的化合价是解答本题的关键,难度不大,注重了对基础知识的考查.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | m=2 | |
| B. | 第二次平衡时,Z的浓度为0.2mol•L-1 | |
| C. | 两次平衡的平衡常数相同 | |
| D. | 又加入1molZ,平衡没有发生移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下用NaOH溶液吸收Cl2 | B. | Na在空气中燃烧 | ||
| C. | Na2O2吸收CO2 | D. | S在空气中燃烧 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 图中A~K分别代表一种物质.已知A易溶于水,分解得到B、C、D的物质的量比为1:1:2,B气体能使品红溶液褪色,C为常见的液体,D气体能使湿润的紫色石蕊试纸变蓝,F为淡黄色固体单质,K为常见的二元强酸,图中有部分生成物未标出.
图中A~K分别代表一种物质.已知A易溶于水,分解得到B、C、D的物质的量比为1:1:2,B气体能使品红溶液褪色,C为常见的液体,D气体能使湿润的紫色石蕊试纸变蓝,F为淡黄色固体单质,K为常见的二元强酸,图中有部分生成物未标出.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化还原反应中,所有元素的化合价都发生变化 | |
| B. | 氧化还原反应前后一定存在氧的得失 | |
| C. | 置换反应一定属于氧化还原反应 | |
| D. | 化合反应和分解反应不可能是氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氮化硅是一种重要的结构陶瓷材料,具有优良性能.
氮化硅是一种重要的结构陶瓷材料,具有优良性能.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com