
A.【物质结构与性质】
可以由下列反应合成三聚氰胺:CaO+3C CaC2+CO↑,CaC2+N2
CaC2+CO↑,CaC2+N2  CN2+C,CaCN2+2H2O===NH2CN+Ca(OH)2,NH2CN与水反应生成尿素[CO(NH2)2],尿素合成三聚氰胺。
CN2+C,CaCN2+2H2O===NH2CN+Ca(OH)2,NH2CN与水反应生成尿素[CO(NH2)2],尿素合成三聚氰胺。
(1)写出与Ca在同一周期且最外层电子数相同、内层排满电子的基态原子的电子排布式: 。 CaCN2中阴离子为CN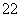 ,根据等电子原理可以推知CN
,根据等电子原理可以推知CN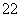 的空间构型为 。
的空间构型为 。
 (2)尿素分子中C原子采取 杂化。尿素分子的结构简式是 。
(2)尿素分子中C原子采取 杂化。尿素分子的结构简式是 。
(3)三聚氰胺( )俗称“蛋白精”。动物摄入三聚氰胺和三聚氰酸( )
后,三聚氰酸与三聚氰胺分子相互之间通过 结合,在肾脏内易形成结石。
(4)CaO晶胞如图所示,CaO晶体中Ca2+的配位数为 。
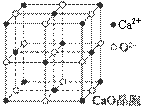

(5)CaO晶体和NaCl晶体的晶格能分别为:CaO 3401 kJ·mol-1、NaCl 786 kJ·mol-1。导致CaO比NaCl晶格能大的主要原因是 。
【知识点】原子核外电子排布 晶格能 分子结构 E1 E3 N4
【答案解析】
(1)1s22s22p63s23p63d104s2或[Ar]3d104s2(2分); ; 直线形(2分)
(2)sp2(1分) ;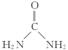 (1分) (3)分子间氢键(2分)
(1分) (3)分子间氢键(2分)
(4)6(2分);
CaO晶体中Ca2+、O2-的带电量大于NaCl晶体中Na+、Cl-的带电量(2分)
解析:(1)与Ca在同一周期且最外层电子数相同、内层排满电子的基态原子是锌,根据构造原理,基态的锌原子核外电子排布式为1s22s22p63s23p63d104s2或[Ar]3d104s2;与CN22-互为等电子体的分子有N2O和CO2;等电子体具有相同的价电子数、原子总数,结构相似,二氧化碳分子是直线形,所以CN22-离子的空间构型是直线形.
(2)CO(NH2)2分子中中心C原子上含有三个σ键一个π键,所以空间构型是平面三角形,碳原子采取sp2杂化.
(3)三聚氰酸与三聚氰胺分子相互之间能形成氢键,所以是通过分子间氢键结合,在肾脏内易形成结石.(4)以钙离子为中心,沿X、Y、Z三轴进行切割,结合图片知,钙离子的配位数是6,晶格能大小与离子带电量成正比,CaO晶体中Ca 2+、O 2-的带电量大于NaCl晶体中Na+、Cl-的带电量,导致的氧化钙晶格能大于氯化钠的晶格能.
【思路点拨】本题考查质结构知识,难度不大,易错点是配位数的确定,一般以一种微粒为中心,沿X、Y、Z三轴进行切割,从而确定配位数。


 一线名师提优试卷系列答案
一线名师提优试卷系列答案 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:
室温下,在0.2mol/L Al2(SO4)3溶液中,逐滴加入1.0mol/L NaOH溶液,实验测得溶液pH随NaOH溶液体积变化曲线如下图,下列有关说法正确的是
A.a点时,溶液呈酸性的原因是Al3+水解,离子方程式为:
Al3+ + 3OH-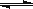 Al(OH)3
Al(OH)3
B.a-b段,溶液pH增大,Al3+浓度不变
C.b-c段,加入的OH-主要用于生成Al(OH)3沉淀
D.d点时,Al(OH)3沉淀开始溶解
查看答案和解析>>
科目:高中化学 来源: 题型:
利用实验器材(规格和数量不限)能够完成相应实验的一项是
| 选项 | 实验器材(省略夹持装置) | 相应实验 |
| A | 三脚架、泥三角、坩埚、坩埚钳 | 煅烧石灰石制取生石灰 |
| B | 烧杯、玻璃棒、胶头滴管、100 mL容量瓶 | 用浓盐酸配制100mL 0.1 mol·L-1的稀盐酸溶液 |
| C | 烧杯、玻璃棒、分液漏斗 | 用饱和Na2CO3溶液除去乙酸乙酯中的乙酸和乙醇 |
| D | 烧杯、酸式滴定管、碱式滴定管 | 用H2SO4标准液滴定未知浓度的NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
为达到相应的实验目的,下列实验的设计或操作最合理的是( )
A.为比较Cl与S元素的非金属性强弱,相同条件下,测定相同浓度的NaCl溶液和Na2S溶液的pH值
B.为观察Mg条在CO2气体中的燃烧,在一个集气瓶中收集满CO2气体,取一小段除去表面氧化膜的Mg条用坩埚钳夹持点燃后迅速投入上述集气瓶底部。
C.为比较HA和HB两种弱酸的Ka大小,可用pH计测定同温同浓度的NaA溶液和NaB 溶液的pH值
D.为测定一定浓度的NaOH溶液放置空气中是否部分转化为Na2CO3,用甲基橙作指示剂,用标准盐酸溶液滴定
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学学习小组设计如图实验装置(夹持装置略去)制备Cl2,并探究氯气的相关性质.
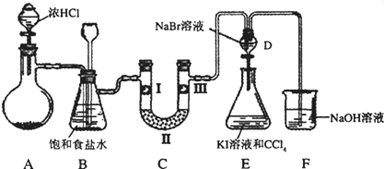
(1)若A装置中固体药品为MnO2,其化学方程式为
若A装置中固体药品为KClO3,则反应中每生成1molCl2时转移电子的物质的量为 mol.
(2)装置B的作用:
(3)装置C的作用是验证氯气是否具有漂白性,l处是湿润的有色布条,则Ⅱ、Ⅲ处应加入的物质分别是 .
(4)设计装置D、E的目的是比较氯、溴、碘的非金属性。但有同学认为该设计不够严密,他的理由可能 。
(5)请用化学方程式说明装置F的作用 。
(6)甲同学提出,装置F中的试剂可改用过量的Na2SO3溶液,乙同学认真思考后认为此法不可行.请用离子方程式解释乙认为不可行的原因:
查看答案和解析>>
科目:高中化学 来源: 题型:
某实验小组用工业上废弃固体(主要成分Cu2S和Fe2O3)混合物制取粗铜和Fe2(SO4)3晶体,设计的操作流程如下:
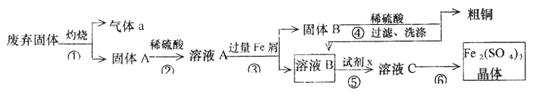
(1)除酒精灯和铁架台或三脚架外,①中所需的容器为_______;①和⑥中都用到的玻璃仪器为______________;
(2)已知试剂x为过氧化氢,写出H2O2与溶液B反应的离子方程式为________________;
(3)某同学取少量的溶液B向其中加入过量的某种强氧化剂,再滴加KSCN溶液,发现溶液变红色,放置一段时间后,溶液褪色,该同学猜测溶液褪色的原因是溶液中的SCN—被过量的氧化剂氧化所致。
现给出以下试剂:1.0 mol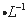 硫酸、1.0 mol
硫酸、1.0 mol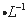 NaOH溶液、0.1 mol
NaOH溶液、0.1 mol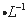 Fe2(SO4)3溶液、20%KSCN溶液、蒸馏水。请你设计合趣实验验证乙同学的猜测是否合理。简要说明实验步骤和现象_________________________________________________________。
Fe2(SO4)3溶液、20%KSCN溶液、蒸馏水。请你设计合趣实验验证乙同学的猜测是否合理。简要说明实验步骤和现象_________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定条件下,充分燃烧一定量的丁烷放出热量为Q kJ(Q>0),经测定完全吸收生成的CO2需消耗 5 mol·L-1的KOH溶液100 mL,恰好生成正盐,则此条件下反应C4H10(g)+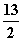
O2(g)===4CO2(g)+5H2O(g)的ΔH为( )
A.8Q kJ·mol-1 B.16Q kJ·mol-1 C.-8Q kJ·mol-1 D.-16Q kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如下图所示(图中的ΔH表示生成1 mol产物的数据)。
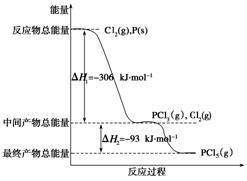
根据上图回答下列问题:
(1) P和Cl2反应生成PCl3的热化学方程式是________________________________
________________________________________________________________________。
(2) PCl5分解成PCl3和Cl2的热化学方程式是_________________________________
________________________________________________________________________。
(3)P和Cl2分两步反应生成1 mol PCl5的ΔH3=__________________,P和Cl2一步反应生成1 mol PCl5的ΔH4____ΔH3(填“大于”、“小于”或“等于”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
开发氢能是实现社会可持续发展的需要。硫铁矿(FeS2)燃烧产生的SO2通过下列碘循环工艺过程既能制H2SO4,又能制H2。
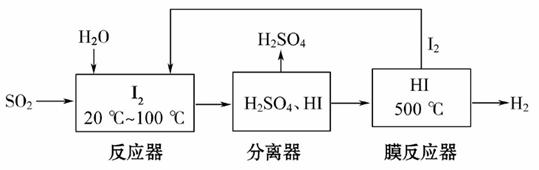
请回答下列问题:
(1)已知1 g FeS2完全燃烧放出7.1 kJ热量,FeS2燃烧反应的热化学方程式为
________________________________________。
(2)该循环工艺过程的总反 应方程式为__________________________________。
应方程式为__________________________________。
(3)用化学平衡移动的原理分析,在HI分解反应中使用膜反应器分离出H2的目的是__________________________________。
(4)用吸收H2后的稀土储氢合金作为电池负极材料(用MH表示),NiO(OH)作为电池正极材料,KOH溶液作为电解质溶液,可制得高容量,长寿命的镍氢电池。电池充放电时的总反应为:
NiO(OH)+MH Ni(OH)2+M
Ni(OH)2+M
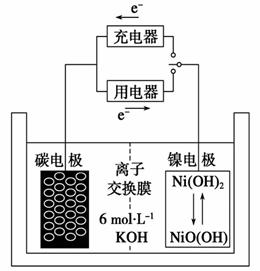
①电池放电时,负极的电极反应式为_________________________________。
②充电完成时,Ni(OH)2全部转化为NiO(OH)。若继续充电将在一个电极产生O2,O2扩散到另一个电极发生电极反应被消耗,从而避免产生的气体引起电池爆炸,此时,阴极的电极反应式为___________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com