
| A. | 0.15 mol•L-1 | B. | 0.10 mol•L-1 | C. | 0.25 mol•L-1 | D. | 0.40 mol•L-1 |
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②⑤ | B. | ②④ | C. | ①②⑤ | D. | ②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加热胆矾失去结晶水,得到白色无水硫酸铜,这一过程叫风化 | |
| B. | 家用石碱(主要成分是Na2CO3•10H2O )久置后,由块状变成粉末状,这一变化是风化的结果 | |
| C. | 含有水蒸气的气体通过固体NaOH 时,固体表面出现水珠,这是固体氢氧化钠潮解的原故 | |
| D. | 从冰箱取出物品,表面很快出现水珠,这种现象叫潮解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
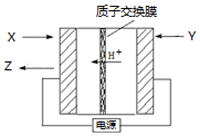 氨是生产氮肥、尿素等物质的重要原料.电化学法是合成氨的一种新方法,其原理如图所示,下列有关说法正确的是( )
氨是生产氮肥、尿素等物质的重要原料.电化学法是合成氨的一种新方法,其原理如图所示,下列有关说法正确的是( )| A. | Y参与的电极反应为H2+2e-=2H+ | |
| B. | 反应过程中左边区域溶液pH逐渐升高 | |
| C. | 图中所示物质中,X为H2,Y为N2 | |
| D. | 当有3g H+通过质子交换膜时,Z的体积为22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④ | B. | ①④ | C. | ①③ | D. | ⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
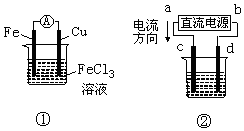
| A. | 装置①是原电池,总反应是:Cu+2Fe3+═Cu2++2Fe2+ | |
| B. | 装置①中,铁做负极,该电极反应式为:Fe3++e-═Fe2+ | |
| C. | 装置②为铁上镀铜装置c为纯铜电极 | |
| D. | 若用装置②精炼铜,则d极为粗铜,c极为纯铜,电解质溶液为CuSO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “地沟油”经过加工处理后,可以用来制肥皂 | |
| B. | 二氧化硫有漂白性,大量用作棉,麻、纸张和食品的漂白 | |
| C. | 汽车尾气污染物中含有氮的氧化物,是汽油不完全燃烧造成的 | |
| D. | PM2.5颗粒(微粒直径约为2.5×10-6m)分散在空气中形成气溶胶 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
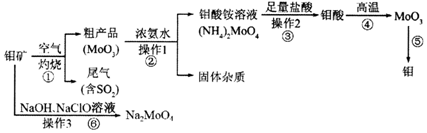
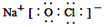 ;反应⑥生成三种钠盐,写出该反应的离子方程式:MoS2+OH-+ClO-=MoO42-+2SO42-+9Cl-+H2O
;反应⑥生成三种钠盐,写出该反应的离子方程式:MoS2+OH-+ClO-=MoO42-+2SO42-+9Cl-+H2O查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com