
科目:高中化学 来源: 题型:阅读理解
| 足量试剂X |
| 足量O2充分灼烧 |
| 密封(容器带自由移动的活塞) |
| ||
| 足量试剂Y |
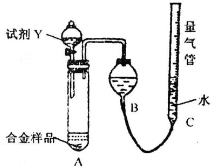
| 1-V3 |
| 6.72 |
| 1-V3 |
| 6.72 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 22.4a |
| 156 |
| 156.8a |
| 264 |
| 22.4a |
| 156 |
| 156.8a |
| 264 |
查看答案和解析>>
科目:高中化学 来源: 题型:
将23.9g表面已锈蚀成铜绿[Cu2(OH)2CO3]的铜片投入120mL一定浓度的硝酸中;充分反应后,硝酸被还原成NO2和NO,测得反应后溶液中H+浓度为0.1 mol?L-1。往反应后的溶液中加入过量的NaOH溶液,滤出沉淀,洗涤,干燥后得到29.4g蓝色固体。(假设反应前后溶液的体积不变)
![]() 计算:(1)已锈蚀的铜片中的铜元素的质量分数为 。(保留两位小数)
计算:(1)已锈蚀的铜片中的铜元素的质量分数为 。(保留两位小数)
![]() (2)求铜片中单质铜的物质的量。(写出计算过程)
(2)求铜片中单质铜的物质的量。(写出计算过程)
![]() (3)若生成NO2和NO混合气体共aL(标准状况下)。
(3)若生成NO2和NO混合气体共aL(标准状况下)。
![]() ①a的取值范围为 。
①a的取值范围为 。
![]() ②原硝酸的浓度为多少?(只需用a的代数式表示,写出过程)
②原硝酸的浓度为多少?(只需用a的代数式表示,写出过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
(8分)将23.9g表面已锈蚀成铜绿[Cu2(OH)2CO3]的铜片投入120mL一定浓度的硝酸中;充分反应后,硝酸被还原成NO2和NO,测得反应后溶液中H+浓度为0.1 mol?L-1。往反应后的溶液中加入过量的NaOH溶液,滤出沉淀,洗涤,干燥后得到29.4g蓝色固体。(假设反应前后溶液的体积不变)
计算:
(1)已锈蚀的铜片中的铜元素的质量分数为 。(保留两位小数)
(2)求铜片中单质铜的物质的量。(写出计算过程)
(3)若生成NO2和NO混合气体共aL(标准状况下)。
①a的取值范围为 。
②原硝酸的浓度为多少?(只需用a的代数式表示,写出过程)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com