
| 化学键 | C-H | C-O | O-H | C=O | O=O | C-C |
| 键能(kJ•mol-1) | 414 | 326 | 464 | 728 | 498 | 332 |
分析 (1)①反应焓变△H=反应物总键能-生成物总键能;
②若2CH3CHO(g)+O2(g)?2CH3COOH(g)反应可自发进行,△H<0,结合热化学方程式和盖斯定律计算分析;
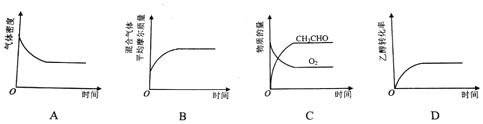
(2)恒温、恒压密闭容器中,发生反应2CH3CH2OH(g)+O2(g)?2CH3CHO(g)+2H2O(g)至平衡状态
A.气体前后质量不变,反应前后气体物质的量增大,随反应进行气体体积增大,密度减小至不变;
B.气体质量不变,气体物质的量增加,随反应进行气体平均摩尔质量减小至不变
C.反应进行乙醛物质的量增大,氧气物质的量减小;
D.乙醇转化率随反应进行增大至不变;
(3)①依据平衡常数计算溶液中氢离子浓度,PH=-lgc(H+);将0.1mol•L-1CH3COOH溶液与0.1mol•L-1的氨水等体积混合得到醋酸氨溶液.醋酸电离程度和一水合氨电离程度相同,水解程度相同溶液呈中性;
②25℃,0.2mol•L-1NH4Cl溶液中NH4+水解,离子方程式为:NH4++H2O?NH3•H2O+H+,反应的平衡常数Kh=$\frac{c(N{H}_{3}•{H}_{2}O)c({H}^{+})}{c(N{{H}_{4}}^{+})}$=$\frac{c(N{H}_{3}•{H}_{2}O)c({H}^{+})}{c(N{{H}_{4}}^{+})}$×$\frac{c(O{H}^{-})}{c(O{H}^{-})}$=$\frac{Kw}{Kb}$;
③25℃,向0.1mol•L-1氨水中加入少量NH4Cl固体,溶解后铵根离子浓度增大,平衡逆向进行,向稀氨水中滴入酚酞试液,然后改变铵根离子浓度观察溶液颜色是否变化来判断是否存在电离平衡.
解答 解:(1)①CH3CH2OH(g)+$\frac{1}{2}$O2(g)?CH3CHO(g)+H2O(g)△H1=414KJ/mol×5+326KJ/mol+464KJ/mol+332KJ/mol+$\frac{1}{2}$×498KJ/mol-3×414KJ/mol-332KJ/mol-326KJ/mol-464KJ/mol-2×464KJ/mol=203 kJ•mol-1 ,
故答案为:203 kJ•mol-1;
②Ⅰ.CH3CH2OH(g)+$\frac{1}{2}$O2(g)?CH3CHO(g)+H2O(g)△H1=203 kJ•mol-1 ,
Ⅱ.2CH3CHO(g)+O2(g)?2CH3COOH(g)△H2=2(3×414KJ/mol+332KJ/mol+326KJ/mol+464KJ/mol)+498KJ/mol-2(3×414KJ/mol+332KJ/mol+326KJ/mol+464KJ/mol+728KJ/mol)=-958KJ/mol
盖斯定律(Ⅰ×2+Ⅱ)×$\frac{1}{2}$得到:CH3CH2OH(g)+O2(g)?CH3COOH(g)+H2O(g)△H=-552KJ/mol,△H2 <0,
故答案为:<;
(2)恒温、恒压密闭容器中,发生反应2CH3CH2OH(g)+O2(g)?2CH3CHO(g)+2H2O(g)至平衡状态
A.气体前后质量不变,反应前后气体物质的量增大,随反应进行气体体积增大,密度减小至不变,图象变化符合,故A不选;
B.气体质量不变,气体物质的量增加,随反应进行气体平均摩尔质量减小至不变,图象变化趋势错误,故B选;
C.反应进行乙醛物质的量增大,氧气物质的量减小,图象中变化趋势正确,故C不选;
D.乙醇转化率随反应进行增大至不变,反应达到平衡状态,故D不选;
故答案为:B;
(3)①Ka(CH3COOH)=$\frac{c(C{H}_{3}CO{O}^{-})c({H}^{+})}{c(C{H}_{3}COOH)}$=$\frac{{c}^{2}({H}^{+})}{0.1}$=1.75×10-5,c(H+)=$\sqrt{1.75×1{0}^{-6}}$mol/L=1.3×10-3mol/L,PH=-lg1.3×10-3mol/L≈2.9,将0.1mol•L-1CH3COOH溶液与0.1mol•L-1的氨水等体积混合得到醋酸氨溶液.醋酸电离程度和一水合氨电离程度相同,水解程度相同溶液呈中性,溶液中离子浓度关系为:c(CH3COO-)=c(NH4+)>c(H+)=c(OH-),
故答案为:2.9; c(CH3COO-)=c(NH4+)>c(H+)=c(OH-);
②25℃,0.2mol•L-1NH4Cl溶液中NH4+水解,离子方程式为:NH4++H2O?NH3•H2O+H+,反应的平衡常数Kh=$\frac{c(N{H}_{3}•{H}_{2}O)c({H}^{+})}{c(N{{H}_{4}}^{+})}$=$\frac{c(N{H}_{3}•{H}_{2}O)c({H}^{+})}{c(N{{H}_{4}}^{+})}$×$\frac{c(O{H}^{-})}{c(O{H}^{-})}$=$\frac{Kw}{Kb}$=$\frac{1{0}^{-14}}{1.75×1{0}^{-5}}$=5.7×10-10,
故答案为:5.7×10-10;
③25℃,向0.1mol•L-1氨水中加入少量NH4Cl固体,铵根离子浓度增大,NH3•H2O?NH4++OH-的电离平衡逆向进行,取少量稀氨水,滴入酚酞试液,溶液呈红色,加入氯化铵晶体,溶液的红色变浅,说明氨水存在电离平衡,氨水电离生成铵根离子和氢氧根离子,加入氯化铵晶体后,溶液中铵根离子浓度增大,使平衡向逆反应方向移动,从而抑制氨水的电离,取少量氨水于试管中,滴加2~3滴酚酞试液,再加入少量醋酸铵固体,充分振荡后溶液红色变浅.证明NH3•H2O 是弱电解质,
故答案为:逆;取少量氨水于试管中,滴加2~3滴酚酞试液,再加入少量醋酸铵固体,充分振荡后溶液红色变浅.证明NH3•H2O 是弱电解质.
点评 本题考查了热化学方程式焓变计算、盖斯定律计算应用、影响电离平衡、化学平衡因素、平衡标志判断、平衡常数计算等,掌握基础是解题关键,题目难度中等.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
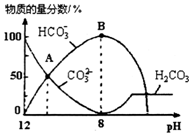 25℃时,H2CO3的Kal=4.2×10-7,Ka2=5.6×10-11.室温下向10mL 0.1mo1•L-1Na2CO3溶液中逐滴加入0.1mo1•L-1HCl溶液.如图是溶液中含碳元素微粒物质的量分数随pH降低而变化的图象(CO2因有逸出未画出).下列说法错误的是( )
25℃时,H2CO3的Kal=4.2×10-7,Ka2=5.6×10-11.室温下向10mL 0.1mo1•L-1Na2CO3溶液中逐滴加入0.1mo1•L-1HCl溶液.如图是溶液中含碳元素微粒物质的量分数随pH降低而变化的图象(CO2因有逸出未画出).下列说法错误的是( )| A. | A点所示溶液的pH<11 | |
| B. | B点所示溶液:c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3) | |
| C. | A点→B点发生反应的离子方程式为CO32-+H+═HCO3- | |
| D. | 分步加入酚酞和甲基橙,用滴定法可测定Na2CO3与NaHCO3混合物的组成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丙烯酸使溴水褪色属于氧化反应 | |
| B. | 丙烯酸能发生加成反应但不能发生取代反应 | |
| C. | 丙烯酸分子中所有碳原子不可能处于同一平面 | |
| D. | 反应CH2=CHCOOH+H2$→_{△}^{Ni}$CH3CH2COOH的原子利用率为100% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性溶液中:Mg2+、K+、SO42-、NO3- | |
| B. | 无色溶液中:Na+、A13+、NO3-、MnO4- | |
| C. | FeCl溶液中:Na+、NH4+、SCN-,SO42- | |
| D. | 与A1反应放出H2的溶液中:NH4+、Na+、NO3-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 结论 |
| A | 某溶液中滴加足量盐酸酸化的 BaCl2溶液 | 生成白色沉淀 | 原溶液中一定含有SO42- |
| B | 将Cl2通入石蕊试液中 | 石蕊试液先变红 后褪色 | C12具有漂白性 |
| C | 用洁净的铂丝蘸取某溶液进行焰色反应实验 | 火焰呈黄色 | 原溶液一定含有Na+,一定不含K+ 有 |
| D | 将KI和FeCl3溶液在试管中混 合后,加入CC14,振荡,静置 | 下层溶液显紫红 色 | 氧化性Fe3+>I2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有大量的氯气泄漏时,用烧碱溶液浸湿软布蒙面,并迅速离开现场 | |
| B. | 金属钠着火燃烧时,用泡沫灭火器灭火 | |
| C. | 少量浓硫酸沾在皮肤上,立即用氢氧化钠溶液冲洗 | |
| D. | 过滤时,玻璃棒与三层滤纸的一边接触 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3 | B. | NaOH、Na2CO3 | ||
| C. | Na2O2、Na2CO3 | D. | Na2O2、NaOH、Na2CO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com