
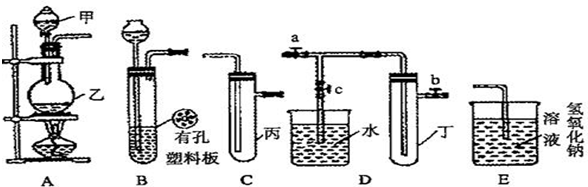
| 实验序号 | 实验操作 | 现象 | 结论 |
| Ⅰ | 将氯水滴入品红溶液 | 溶液褪色 | 氯气与水反应的产物有漂白性 |
| Ⅱ | 氯水中加入NaHCO3粉末 | 有无色气泡产生 | 氯气与水反应的产物具有较强的酸性 |
| ||
| ||


科目:高中化学 来源: 题型:阅读理解
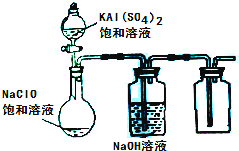 (2013?达州模拟)NaClO和KAl(SO4)2都是重要的化工产品,均可应用于造纸业.
(2013?达州模拟)NaClO和KAl(SO4)2都是重要的化工产品,均可应用于造纸业.
| ||
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源:2011-2012年浙江宁波万里国际中学高二第二学期期中考试化学试卷(带解析) 题型:填空题
某课外活动小组同学用下图装置进行实验,一段时间后在C电极表面有铜析出,试回答下列问题。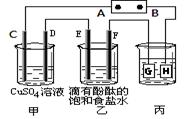
(1)A为电源的 极;
(2)E的电极反应式为: ;
(3)若甲、乙装置中的C、D、E、F电极均只有一种单质生成时,对应单质的物质的量之比为 ;
(4)在常温下,现用丙装置给铁镀铜,则H电极材料应该是 ,
当丙中铁表面析出铜的3.2g时,乙中溶液的PH值为 (假设溶液体积为1L);
(5)在电解一段时间后在甲中加入适量 可以使溶液恢复到原来的浓度。
查看答案和解析>>
科目:高中化学 来源:2011-2012年浙江宁波万里国际中学高二第二学期期中考试化学试卷(解析版) 题型:填空题
某课外活动小组同学用下图装置进行实验,一段时间后在C电极表面有铜析出,试回答下列问题。
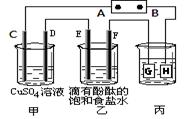
(1)A为电源的 极;
(2)E的电极反应式为: ;
(3)若甲、乙装置中的C、D、E、F电极均只有一种单质生成时,对应单质的物质的量之比为 ;
(4)在常温下,现用丙装置给铁镀铜,则H电极材料应该是 ,
当丙中铁表面析出铜的3.2g时,乙中溶液的PH值为 (假设溶液体积为1L);
(5)在电解一段时间后在甲中加入适量 可以使溶液恢复到原来的浓度。
查看答案和解析>>
科目:高中化学 来源:2010-2011学年四川省成都市高三“三诊”模拟考试(理综)化学部分 题型:填空题
.(16分)某课外活动小组同学用下图装置进行实验,试回答下列问题。
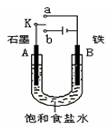
(1)若开始时开关K与a连接,则B极的电极反应式为 。
(2)若开始时开关K与b连接,则B极的电极反应式为 ,总反应的离子方程式为 ,有关该实验的下列说法正确的是(填序号) 。
①溶液中Na+向A极移动 ②从A极处逸出的气体能使湿润KI淀粉试纸变蓝 ③反应一段时间后加适量盐酸可恢复到电解前电解质的浓度 ④若标准状况下B极产生2.24 L气体,则溶液中转移0.2 mol电子
(3)该小组同学模拟工业上用离子交换膜法制烧碱的方法,设想用下图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。
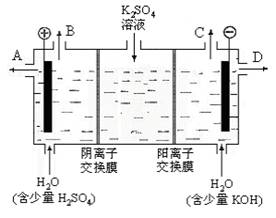
①该电解槽的阳极反应式为 。此时通过阴离子交换膜的离子数 (填“大于”或“小于”或“等于”)通过阳离子交换膜的离子数。
②制得的氢氧化钾溶液从 出口 (填写“A”、“B”、“C”、“D”)导出。
③通电开始后,阴极附近溶液pH会增大,请简述原因 。
④若将制得的氢气、氧气和氢氧化钾溶液组合为氢氧燃料电池,则电池正极的电极反应式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com