
【题目】已知101kPa时的辛烷的燃烧热为5518kJ/mol,强酸与强碱在稀溶液中发生反应时的中和热为57.3kJ/mol,则下列热化学方程式书写正确的是
①C8H18(l)+![]() O2(g)=8CO2(g)+9H2O(l);△H=+5518kJ/mol;
O2(g)=8CO2(g)+9H2O(l);△H=+5518kJ/mol;
②C8H18(l)+![]() O2(g)=8CO2(g)+9H2O(l);△H=﹣5518kJ/mol;
O2(g)=8CO2(g)+9H2O(l);△H=﹣5518kJ/mol;
③![]() H2SO4(aq)+Ba(OH) 2(aq)=
H2SO4(aq)+Ba(OH) 2(aq)=![]() BaSO4(s)+H2O(l);△H=﹣57.3kJ/mol;
BaSO4(s)+H2O(l);△H=﹣57.3kJ/mol;
④H+(aq)+OH﹣(aq)=H2O(l);△H=﹣57.3kJ/mol.
A.①③B.②③C.②④D.②③④
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.9g水中含有的原子总数为1.5×6.02×1023
B.1.0mol·L-1氯化镁溶液中含有Cl-数为2.0×6.02×1023
C.标准状况下,11.2L四氯化碳中含有的分子数为0.5×6.02×1023
D.钠与水反应时,每反应0.1mol钠,转移电子数为0.2×6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从钴镍废渣(主要成分为Co2O3、NiS及铁、铝等元素的化合物等杂质)中提取制备锂离子电池的电极材料LiCoO2的工艺如下:
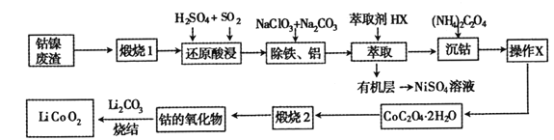
已知:CoC2O4 2H2O 微溶于水,它的溶解度随温度升高而逐渐增大,且能与过量的![]() 离子生成
离子生成![]() 而溶解。
而溶解。
(1) “煅烧1”的主要目的是________________。
(2) “还原酸浸”过程中Co2O3发生反应的离子方程式为 ______________。
(3) “除铁、铝”过程的两种试剂的作用分别是______________________。
(4)“沉钴”过程中,(NH4)2C2O4的加入量(图a)、沉淀反应的温度(图b)与钴的沉淀率关系如图所示:
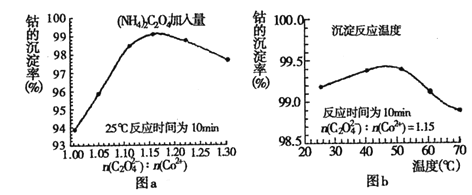
①随n(![]() ):n(Co2+) 比值的增加,钴的沉淀率又逐渐减小的原因是__________。
):n(Co2+) 比值的增加,钴的沉淀率又逐渐减小的原因是__________。
②沉淀反应时间为10min,当温度高于50℃以上时,钴的沉淀率下降的原因可能是_______。
(5)为了获得较为纯净的CoC2O42H2O,“操作X”的实验操作为_______________。
(6)已知煅烧CoC2O42H2O时温度不同,产物不同。400℃时在空气中充分煅烧,得到钴的氧化物质量为2.41g,CO2的体积为1.344L(标准状况下),则此时所得钴的氧化物的化学式为____________ 。
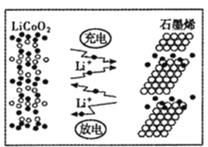
(7)利用锂离子能在石墨烯表面和电极之间快速大量穿梭运动的特性,开发出石墨烯电池,电池反应式为LixC6+Li1-xCoO2![]() C6+ LiCoO2,其工作原理如图。则充电时LiCoO2的电极反应式为__________________。
C6+ LiCoO2,其工作原理如图。则充电时LiCoO2的电极反应式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验“操作和现象”与“结论”对应且正确的是( )
操作和现象 | 结论 | |
A | 向盛有浓硫酸的试管中加入铜片,铜片很快开始溶解,并放出刺激性气味的气体 | 浓硫酸具有强氧化性 |
B | 向两支盛有KI3的溶液的试管中,分别滴加淀粉溶液和硝酸银溶液,前者溶液变蓝,后者有黄色沉淀 | KI3溶液中存在平衡:I |
C | 向一定量的硝酸银溶液中先滴加KCl溶液,再滴加KI溶液,先出现白色沉淀,后出现黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
D | 室温下,用pH试纸分别测定浓度为0.1mol/LNaClO溶液和0.1mol/LCH3COONa溶液的pH | 比较HClO和CH3COOH的酸性强弱 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:用NH3催化还原NOx时包含以下反应.
反应①:4NH3 (g)+6NO(g) ![]() 5N2(g)+6H2O(l) H1=-1 807. 0 kJ·mol—1,
5N2(g)+6H2O(l) H1=-1 807. 0 kJ·mol—1,
反应②:4NH3(g)+6NO2(g) ![]() 5N2(g)+3O2(g)+6H2O(l) H2=?
5N2(g)+3O2(g)+6H2O(l) H2=?
反应③:2NO(g)+O2(g) ![]() 2NO2(g) H3=-113.0kJ·mol一1
2NO2(g) H3=-113.0kJ·mol一1
(1)反应②的H2==_____________。
(2)为探究温度及不同催化剂对反应①的影响.分别在不同温度、不同催化剂下.保持其他初始条件不变重复实验.在相同时间内测得N2浓度的变化情况如下图所示。

①反应①的平衡常数的表达式K=________。相同温度下.在催化剂甲的作用下反应的平衡常数______(填“大于”“小于”或“等于”)在催化剂乙的作用下反应的平衡常数。
②N点后N2浓度减小的原因可能是_____________________。
(3)某温度下,在1 L恒容密闭容器中初始投入4 mol NH3和6 mol NO发生反应①.当气体总物质的量为7.5mol时反应达到平衡.则NH3的转化率为____,达平衡所用时间为5 min.则用NO表示此反应0~5 min内的平均反应速率为______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲酸在有机化工中有广泛的用途,工业上可有多种途径来制备甲酸。回答下列问题:
(1)利用光催化制甲酸原理如图所示。
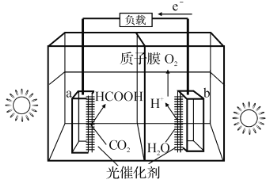
该装置能量转化方式为___。
(2)另一种以Ru化合物为催化剂,用H2和CO2制取甲酸的反应机理如下:
第一步:Ru(OH)2+2H2RuH2+2H2O 快速平衡
第二步:RuH2+2CO2→Ru(OOCH)2 慢反应(近似认为不影响第一步反应的平衡)
第三步:Ru(OOCH)2+2H2O→2HCOOH+Ru(OH)2 快反应
下列表述正确的是___ (填序号)。
A.平衡时v(第一步的逆反应)>v(第二步反应)
B.反应的中间产物只有Ru(OOCH)2
C.第二步反应中RuH2与CO2的碰撞仅部分有效
D.第三步反应的活化能较低
(3)CO2加氢也可制备甲酸(HCOOH)。
①工业上利用甲酸的能量关系转换图如图:
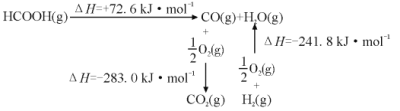
反应CO2(g)+H2(g) HCOOH(g)的焓变△H=___kJ·mol-1。
②温度为T1℃时,将等物质的量的CO2和H2充入体积为1L的密闭容器中发生反应:CO2(g)+H2(g) HCOOH(g) K=2
实验测得:v正=k正c(CO2)·c(H2),v逆=k逆c(HCOOH),k正、k逆为速率常数。T1℃时,k逆=___(以k正表示)。
③当温度改变为T2℃时,k正=1.9k逆,则T2℃时平衡压强___T1℃时平衡压强(填“>”“<”或“=”),理由是___。
(4)甲酸是唯一能和烯烃发生加成反应的羧酸,目前,科学家正在研究一种以乙烯作为还原剂的脱硝(NO)原理,其脱硝机理示意图如图1,脱硝率与温度、负载率(分子筛中催化剂的质量分数)的关系如图2所示。
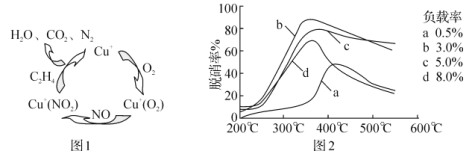
①写出该脱硝原理总反应的化学方程式:___。
②为达到最佳脱硝效果,应采取的条件是___。
(5)T℃,甲酸与醋酸钠溶液反应:HCOOH+CH3COO- HCOO-+CH3COOH,该反应的平衡常数为12.5,则该温度下醋酸的电离常数Ka(CH3COOH)=___(T℃时甲酸的电离常数为2×10-4)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO和H2在一定条件下可以合成乙醇:2CO(g) + 4H2(g)![]() CH3CH2OH(g) + H2O(g),下列叙述中,能说明上述反应在一定条件下一定达到最大限度的是
CH3CH2OH(g) + H2O(g),下列叙述中,能说明上述反应在一定条件下一定达到最大限度的是
A. CO全部转化为乙醇
B. 断4NA个H-H键的同时,生成46g乙醇
C. 若反应在恒温恒容密闭容器中进行,容器中混合气体的密度不再改变
D. 若反应在绝热恒容密闭容器中进行,容器中温度不再改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国传统文化对人类文明贡献巨大,我国古代就已经广泛应用了相关的化学知识,下列关于古代化学的应用和记载中,说法不合理的是( )
A.曹植诗句“煮豆燃豆萁,豆在釜中泣”,这里的能量变化主要是化学能转化为热能
B.我国古代人民常用明矾水除去铜器上的铜锈![]()
C.锡青铜![]() 铜锡合金
铜锡合金![]() 文物在潮湿环境中的腐蚀比干燥环境中快
文物在潮湿环境中的腐蚀比干燥环境中快
D.晋代炼丹家、医学家葛洪所著![]() 抱扑子
抱扑子![]() 一书中记载有“丹砂烧之成水银,积变又还成丹砂”。这个过程为可逆反应
一书中记载有“丹砂烧之成水银,积变又还成丹砂”。这个过程为可逆反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)![]() 2NO2(g),随温度升高,混合气体的颜色变深。
2NO2(g),随温度升高,混合气体的颜色变深。
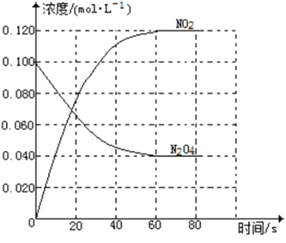
回答下列问题:
(1)反应的△H______0(填“大于”“小于”);100℃时,体系中各物质浓度随时间变化如上图所示。在0~60s时段,反应速率v(N2O4)为___________molL-1s-1反应的平衡常数K1为___________。
(2)100℃时达到平衡后,改变反应温度为T,c(N2O4)以0.0020 molL-1s-1的平均速率降低,经10s又达到平衡。
①T_______100℃(填“大于”“小于”),判断理由是_____。
②列式计算温度T是反应的平衡常数K2___________
(3)温度T时反应达平衡后,将反应容器的容积减少一半,平衡向___________(填“正反应”或“逆反应”)方向移动,判断理由是___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com