
 某省2005年工业(主要是热电厂)二氧化硫排放总量为1.24×106 t,全省酸雨污染比较严重.分析降雨成分发现,雨水中阴离子仍以硫酸根离子为主,约占阴离子总量的61.9%,阳离子以铵根离子为主,约占阳离子总量的84.1%.阴离子中SO42-和NO3-的质量比为4.13:1,NO3-的比例呈明显上升的趋势.回答下列问题:
某省2005年工业(主要是热电厂)二氧化硫排放总量为1.24×106 t,全省酸雨污染比较严重.分析降雨成分发现,雨水中阴离子仍以硫酸根离子为主,约占阴离子总量的61.9%,阳离子以铵根离子为主,约占阳离子总量的84.1%.阴离子中SO42-和NO3-的质量比为4.13:1,NO3-的比例呈明显上升的趋势.回答下列问题: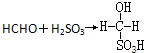
分析 (1)根据前些年雨水中阴离子主要以SO2-4离子为主,近几年雨水中NO3-的比例呈明显地升的趋势,说明含氮污染物排放增多,煤烟型污染主要是造成二氧化硫的污染,机动车尾气型污染会造成含氮化合物的大量排放;
(2)空气中的二氧化硫在氧气和水的共同作用下,会形成酸雾,空气中的硫的氧化物和氮的氧化物随雨水降下就形成酸雨.酸雨能直接破坏农作物、森林和草原,使土壤酸性增强.酸雨还会使湖泊酸化,造成鱼类死亡.另外,酸雨还会加速建筑物、桥梁、工业设备,以及电信电缆的腐蚀.工业废气需净化后才能向大气中排放,防止造成大气污染及浪费硫资源;
(3)①根据污染物的来源不同,选择不同的地点;
②依据汞盐是重金属盐污染环境分析;
③依据反应过程分析可知是亚硫酸加成羰基;测定气体二氧化硫含量需要记录吸收一定温度、压强下的空气的体积,
解答 解:(1)根据前些年雨水中阴离子主要以SO2-4离子为主,近几年雨水中NO3-的比例呈明显地升的趋势,说明含氮污染物排放增多,煤烟型污染主要是造成二氧化硫的污染,机动车尾气型污染会造成含氮化合物的大量排放,故可推断是由煤烟型向煤烟型与机动车尾气混合型转化,故选:C,
故答案为:C;
(2)酸雨成因:空气中的二氧化硫在氧气和水的共同作用下,会形成酸雾SO2+H2O?H2SO3,2H2SO3+O2═2H2SO4,空气中的硫的氧化物和氮的氧化物随雨水降下就形成酸雨;酸雨危害:酸雨能直接破坏农作物、森林和草原,使土壤酸性增强.酸雨还会使湖泊酸化,造成鱼类死亡.另外,酸雨还会加速建筑物、桥梁、工业设备,以及电信电缆的腐蚀;
防治措施:加强燃煤的脱硫处理和燃煤尾气中SO2的处理;强化机动车的尾气净化装置的安装管理等,工业废气需净化后才能向大气中排放,防止造成大气污染及浪费硫资源;
故答案为:加强燃煤的脱硫处理和燃煤尾气中SO2的处理;强化机动车的尾气净化装置的安装管理等;
(3)①某研究小组拟选择“不同地点空气中二氧化硫的含量分析”为课题进行探究,根据引起污染的原因不同选择地点,建议选择的测定地点分别是公园、交通繁忙的地方、工厂、学校、村庄(或居民住宅区)、公园(或农田)等;
故答案为:工厂、学校、村庄(或居民住宅区)、公园(或农田)等;
②采用HgCl2、NaCl的混合溶液吸收二氧化硫,甲醛溶液吸收二氧化硫.变更吸收剂的原因除了用甲醛溶液的吸收效果比较好外,另一个原因可能是汞盐毒性大污染环境,
故答案为:汞盐毒性大污染环境;
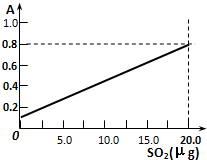
③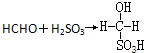 反应是亚硫酸加成羰基的过程属于加成反应,若欲测定某地空气中二氧化硫的含量(mg•m-3),除需要测定吸光度A外还需要记录的数据为吸收的空气的体积,吸收空气时的温度、大气压强,
反应是亚硫酸加成羰基的过程属于加成反应,若欲测定某地空气中二氧化硫的含量(mg•m-3),除需要测定吸光度A外还需要记录的数据为吸收的空气的体积,吸收空气时的温度、大气压强,
故答案为:加成反应;吸收的空气的体积,吸收空气时的温度、大气压强.
点评 本题考查了物质性质的探究方法和实验分析判断,污染气体生物处理方法和过程分析,掌握基础是关键,题目难度中等.


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ①③ | C. | ①④ | D. | ②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 发酵粉中主要含有氢氧化钠,能使焙制出的糕点疏松多孔 | |
| B. | 碘盐中的碘可以直接用淀粉检验 | |
| C. | 碳酸氢钠可用于治疗胃酸过多 | |
| D. | 硫酸氢钠属于盐类,其水溶液显中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
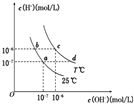 在不同温度下,水溶液中c(H+)与c(OH-)有如图所示关系.下列条件关于离子共存说法中正确的是( )
在不同温度下,水溶液中c(H+)与c(OH-)有如图所示关系.下列条件关于离子共存说法中正确的是( )| A. | a点对应的溶液中大量存在:CO32-、Na+、Cl-、SO42- | |
| B. | b点对应的溶液中大量存在:Fe2+、Ba2+、K+、NO3- | |
| C. | c点对应的溶液中大量存在:Na+、Ba2+、Cl-、Al3+ | |
| D. | d点对应的溶液中大量存在:Na+、K+、ClO-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫的还原性 | B. | 硫的氧化性 | ||
| C. | 二氧化硫的还原性 | D. | 二氧化硫的漂白性 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 向乙酸乙酯中加入足量的30%NaOH溶液,在加热的条件下观察酯层的消失 | |
| B. | 乙醇与浓硫酸混合,加热至140℃制取乙烯 | |
| C. | 向2mL的甲苯中加入3滴KMnO4酸性溶液,用力振荡,观察溶液颜色褪去 | |
| D. | 1 mol•L-1CuSO4溶液2 mL和0.5mol•L-1NaOH溶液2mL混合后加入40%的乙醛溶液0.5mL,加热煮沸观察砖红色沉淀的生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 应用高效洁净的能源转换技术,推广使用节能环保材料 | |
| B. | 大力发展火力发电,解决电力紧张问题 | |
| C. | 研发以高纯硅为核心材料的光伏发电技术 | |
| D. | 大力开发新能源,如核能、太阳能、风能等,减少化石能源的使用 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com