
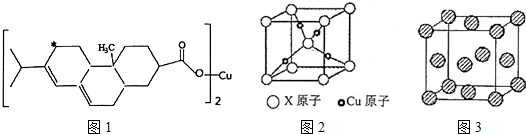
分析 (1)Cu原子核外有29个电子,其3d、4s电子为其外围电子,基态铜原子在灼烧时外围电子发生了 跃迁吸收了一定波长的光,从而使灼烧的火焰呈绿色;
(2)松脂酸铜分子中碳碳双键和碳氧双键中都有π键,结合脂酸铜分子的结构简式计算π键的个数,加“*”碳原子周围有两个碳碳键和两个碳氢键,据此判断杂化方式;
(3)根据图2利用均摊法计算出X原子和铜原子数,进而确定化学式;根据晶胞图可知,以顶点X原子为例,与X等距离且最近的X原子位于晶胞的体心,据此答题;
(4)SO2分子中硫原子的价层电子对数为$\frac{6}{2}$=3,含有两个S-O键,一个孤电子对,据此判断几何构型,根据元素周期律,同主族元素从上向下第一电离能减小;
(5)为面心立方晶胞的物质的量为$\frac{1}{{N}_{A}}$,所以晶胞的体积为:$\frac{\frac{1}{{N}_{A}}×257}{8.5}$cm3,据此求晶胞的边长.
解答 解:(1)Cu原子核外电子数为29,根据能量最低原理,外围电子排布式为:3d104s1,基态铜原子在灼烧时外围电子获得能量,发生跃迁而变为激发态,焰色反应为绿色,
故答案为:3d104s1;跃迁;
(2)1个松脂酸铜中含有个双键,则含有6个π键,加“*”碳原子形成4个σ键,没有孤对电子,杂化轨道数目为4,采取sp3杂化,
故答案为:6;sp3;
(3)晶胞中Cu原子数目为4,X原子数目为1+8×$\frac{1}{8}$=2,故化学式为Cu2X,体心X原子与晶胞顶点的X原子距离为晶胞棱长的$\frac{\sqrt{3}}{2}$倍,而位于面心对角线X原子之间距离为棱长的$\sqrt{2}$倍,故体心X原子与晶胞顶点的X原子距离最近,X原子配位数为8,
故答案为:Cu2X;8;
(4)S原子孤对电子数为$\frac{6-2×2}{2}$=1、价层电子对数=2+1=3,故其空间结构为V形,同主族自上而下第一电离能减小,则第一电离能S<O,
故答案为:V形;<;
(5)为面心立方晶胞的物质的量为$\frac{1}{{N}_{A}}$,所以晶胞的体积为:$\frac{\frac{1}{{N}_{A}}×257}{8.5}$cm3,所以晶胞的边长为:$\root{3}{\frac{257}{8.5N{\;}_{A}}}$cm,故答案为:$\root{3}{\frac{257}{8.5N{\;}_{A}}}$cm.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、杂化方式与空间构型判断、晶胞计算、电离能等,难度不大,掌握利用均摊法进行晶胞计算,注意同周期第一电离能异常情况.


科目:高中化学 来源: 题型:选择题
| A. | 分液、萃取、蒸馏?????????? | B. | 萃取、蒸馏、分液 | ||
| C. | 分液、蒸馏、萃取????????? | D. | 蒸馏、萃取、分液 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.5mol•L-1 | B. | 3mol•L-1 | C. | 3.5mol•L-1 | D. | 4mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
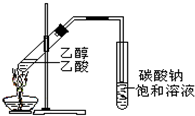 在实验室我们可以用如图所示的装置制取乙酸乙酯.回答下列问题:
在实验室我们可以用如图所示的装置制取乙酸乙酯.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
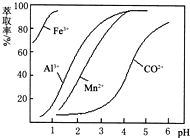
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
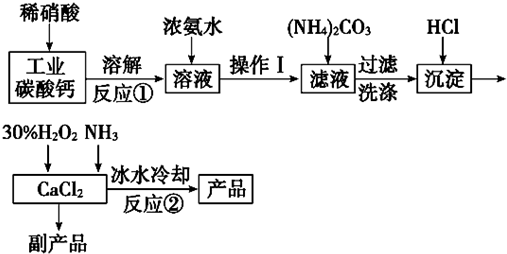
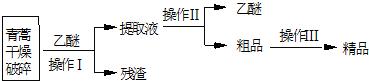
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
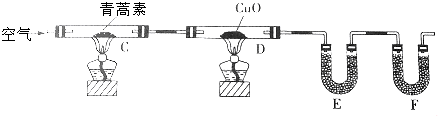
| 装置 | 实验前/g | 实验后/g |
| E | 22.6 | 42.4 |
| F | 80.2 | 146.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

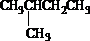
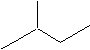

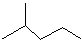
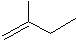
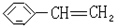 苯乙烯
苯乙烯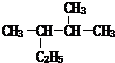 2,3-二甲基戊烷
2,3-二甲基戊烷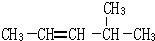 4-甲基-2戊烷
4-甲基-2戊烷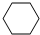 环己烷.
环己烷.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com