
【题目】三氯氧磷(POCl3)可用作有机合成的氯化剂和催化剂。
已知:①KSCN+AgNO3=AgSCN↓+KNO3;
②Ksp(AgCl) > Ksp(AgSCN);
③磷酸银可溶于硝酸;
④PCl3和POCl3的相关信息如下表:
物质 | 熔点/℃ | 沸点/℃ | 相对分子质量 | 性质 |
PCl3 | -111.8 | 74.2 | 137.5 | 均为无色液体,遇水均剧烈水解,生成含氧酸和氯化氢,两者互溶。 |
POCl3 | 2.0 | 105.3 | 153.5 |
实验室制取POCl3并测定产品纯度的实验过程如下:
Ⅰ.制备POCl3可用氧气氧化液态PCl3的方法。实验装置(加热及夹持装置省略)如下:
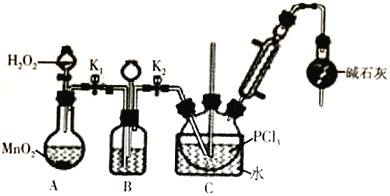
(1)装置C中盛装PCl3的仪器名称为_______________________;氧气氧化PCl3的化学方程式为_______________________________。
(2)仪器组装完成后,检查装置B气密性的方法是_______________________________。
(3)装置B的作用有________________________________(回答两点)。
(4)装置C的反应温度控制在60-65℃之间,原因是____________________________________。
Ⅱ.测定产品中POCl3纯度的实验步骤:
①实验Ⅰ结束后,待反应器中液体冷却到室温,准确称取1.3300 g的POCl3粗产品(杂质不含氯元素),置于盛有50.00mL蒸馏水的烧杯中摇动至完全水解,将水解液配成100.00mL溶液;
②取10.00mL溶液于锥形瓶中,加入30.00mL0.1200mol·L-1AgNO3标准溶液;
③加入少量硝基苯,用力摇动,静置;
④加入指示剂,用0.1000 mol·L-1KSCN溶液滴定过量的AgNO3溶液,到达终点时共用去12.00mLKSCN溶液。
(5)滴定过程中选择的指示剂为___________溶液。
(6)步骤③的目的是___________________________________________________。
(7)测得产品中POCl3的纯度为__________%。
【答案】 三颈烧瓶 2PCl3+O2![]() 2POCl3 关闭K1、K2,向装置B中的长颈漏斗内加水至形成一段水柱,一段时间后若水柱高度不再变化,则装置B的气密性良好 干燥氧气、观察氧气流速、平衡气压等 温度过低,反应速率小;温度过高,三氧化磷会挥发,影响产品的产量 硫酸铁 使AgCl沉淀表面被有机物覆盖,避免在滴加KSCN时,将AgC1沉淀转化为AgSCN沉淀 92.33
2POCl3 关闭K1、K2,向装置B中的长颈漏斗内加水至形成一段水柱,一段时间后若水柱高度不再变化,则装置B的气密性良好 干燥氧气、观察氧气流速、平衡气压等 温度过低,反应速率小;温度过高,三氧化磷会挥发,影响产品的产量 硫酸铁 使AgCl沉淀表面被有机物覆盖,避免在滴加KSCN时,将AgC1沉淀转化为AgSCN沉淀 92.33
【解析】(1)装置C中盛放PCl3的仪器为三颈瓶或者说是三颈烧瓶。氧气将PCl3氧化为POCl3,所以方程式为2PCl3+O2![]() 2POCl3。
2POCl3。
(2)B装置检验气密性的方法应该选择“液差法”,具体的操作为:关闭K1、K2,向装置B中的长颈漏斗内加水至形成一段水柱,一段时间后若水柱高度不再变化(或者说液面差保持不变),则装置B的气密性良好。
(3)B中浓硫酸起到对氧气进行干燥的作用,中间的长颈漏斗起到平衡压强,防堵塞的安全瓶作用(如果后面的装置中某处被堵塞,则B中长颈漏斗内的液面会上升),同时根据浓硫酸中冒气泡的快慢可以判断气体的流速大小。
(4)装置C的反应温度控制在60-65℃之间,原因是温度如果低于该温度,反应的速率会比较慢,温度如果高于该温度PCl3会被蒸出(题目已知PCl3的沸点为74.2℃)。
(5)因为标准液为KSCN溶液,所以可以选用含有Fe3+的溶液为指示剂,根据溶液的颜色突然变为血红色,判断滴定终点(注意不能使用氯化铁,因为氯离子会与银离子反应),所以指示剂为硫酸铁溶液。
(6)本实验的测定原理是:将POCl3水解,所有的氯都转化为氯离子,再加入定量且过量的硝酸银溶液,将氯离子都沉淀为氯化银,再用KSCN溶液滴定过量的硝酸银,根据加入的KSCN的量可以计算出硝酸银过量多少,再用硝酸银总量减去过量的硝酸银得到与氯离子反应的硝酸银,进而计算出氯离子的量,再换算为POCl3的量。题目已知Ksp(AgCl) > Ksp(AgSCN),即AgSCN是比AgCl更难溶的沉淀,则加入过量的硝酸银得到氯化银沉淀后,再用KSCN溶液的滴定的过程中,有可能发生沉淀转化,AgCl + SCN-![]() AgSCN + Cl-从而影响滴定结果,所以加入少量硝基苯后,因为硝基苯的密度大于水,且不溶于水,就会附着在氯化银沉淀的表面,将氯化银沉淀和溶液隔离,避免的上述沉淀转化反应的发生。
AgSCN + Cl-从而影响滴定结果,所以加入少量硝基苯后,因为硝基苯的密度大于水,且不溶于水,就会附着在氯化银沉淀的表面,将氯化银沉淀和溶液隔离,避免的上述沉淀转化反应的发生。
(7)加入的KSCN为0.1×12÷1000=1.2×10-3mol,说明过量的硝酸银也是1.2×10-3mol,加入的硝酸银为0.12×30÷1000=3.6×10-3mol,所以与氯离子反应的硝酸银为3.6×10-3-1.2×10-3 = 2.4×10-3mol,从而得到氯离子为2.4×10-3mol,根据氯守恒得到POCl3为8×10-4mol,考虑到实验时将水解液配成100.00mL溶液,取其中10.00mL溶液进行滴定,所以POCl3为8×10-3mol,质量为153.5×8×10-3=1.228g,质量分数为1.228÷1.33 = 92.33%。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】镓是制作高性能半导体的重要原料。在工业上经常从锌矿冶炼的废渣中回收镓。已知锌矿渣中含有Zn、Fe、Pb、Ga以及二氧化硅等,目前综合利用锌矿渣的流程如下:
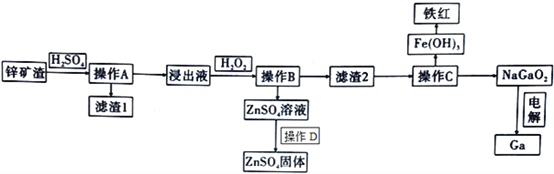
已知:①Ga性质与铝相似。
②lg2=0.3,lg3=0.48。
③如下表所示。
Zn(OH)2 | Ga(OH)3 | Fe(OH)2 | Fe(OH)3 | |
Ksp | 1.6×10-17 | 2.7×10-31 | 8×10-16 | 2.8×10-39 |
(1)写出Ga的原子结构示意图______________________________。
(2)滤渣1的成分为________________________。
(3)加入H2O2的目的( 用离子方程式和适当语言回答) ____________________________________。
(4)室温条件下,若浸出液中各种阳离子的浓度均为0.01mo/L且某种离子浓度小于1×10-5 mol/L即认为该离子已完全除去,问操作B调节pH的范围是________________________。
(5)操作C中,需要加入氢氧化钠溶液,其目的是_____________________ (用离子方程式解释);能否用氨水代替NaOH溶液,为什么? ________________________;如何检测Fe(OH)3洗涤干净? ________________________。
(6)在工业上,经常用电解NaGaO2溶液的方法生产Ga,写出阴极的电极反应方程式:____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(2018·天津市十二重点中学毕业班联考)已知:25℃时H2C2O4的pKa1=1.22,pKa2=4.19,CH3COOH的pK a=4.76,K代表电离平衡常数,pK = -1gK。下列说法正确的是
A. 浓度均为0.1mol·L-1NH4HC2O4和CH3COONH4溶液中:c(NH4+)前者小于后者
B. 将0.1mol·L-1的K2C2O4溶液从25℃升温至35℃,![]() 减小
减小
C. 0.1 mol·L-1K2C2O4溶液滴加盐酸至pH=1.22:c(H+)-c(OH-)=c(Cl-)-3c(HC2O4-)
D. 向0.1 mol·L-1CH3COONa溶液中滴加少量0.1 mol·L-1H2C2O4溶液:CH3COO- + H2C2O4 = CH3COOH + HC2O4-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次增大。m、P、q、r、s是由这些元素组成的二元化合物,常温常压下r为液体,其余均为无色气体。m的摩尔质量为p的2倍,n是元素Y的单质,是绿色植物光合作用产生的无色气体,p物质能使湿润的红色石蕊试纸变蓝,q能使品红溶液褪色。上述物质的转化关系如下图所示。下列说法正确的是

A. q与s均为酸性氧化物 B. 原子半径:W<Y<X
C. Z的氢化物比Y的氢化物稳定 D. Z的含氧酸是一种强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于恒定容积的密闭容器中进行的反应A(s)+B(g)![]() 2C(g) ΔH<0,平衡后只改变下列条件,有关叙述正确的是
2C(g) ΔH<0,平衡后只改变下列条件,有关叙述正确的是
A. 加入少量A物质,平衡正向移动,正反应速率加快
B. 加入少量B物质,平衡正向移动,逆反应速率减小
C. 充入氩气(不参加反应),平衡逆向移动,逆反应速率加快
D. 升高温度,平衡逆向移动,正反应速率和逆反应速率都加快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将铁粉放入由盐酸、MgCl2溶液、FeCl3溶液、CuCl2溶液组成的混合液中,充分反应后,铁粉有剩余,则溶液含有大量的阳离子是( )
A.Cu2+和Fe2+
B.H+和Cu2+
C.Fe3+和Fe2+
D.Fe2+和Mg2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(Ⅰ)有以下10种物质:①液态氯化氢、②CCl4、③液氯、④硫酸铵晶体、⑤铁、⑥稀硫酸、⑦澄清石灰水、⑧二氧化硫,⑨熔融的硫酸钠、⑩Na2O固体。其中属于电解质的是_______(填序号,下同),属于非电解质的是_________,在现状态下能导电的是__________,写出④在水溶液中电离的方程式__________。
(Ⅱ)A、B、C是三种元素的原子,质子数都小于18。A原子与B原子的最外层电子数都是6,A原子与C原子的核外电子层数都为3, C原子的质子数比A少4。回答下列问题:
(1)C的离子结构示意图为_________;
(2)元素A的一种质量数为32的核素,与元素B的一种核素构成微粒为AB42-,1mol AB42-的质量为104g,则元素B的该核素中的中子数为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属铬与铁具有相似的化学性质。醋酸亚铬水合物[Cr(CH3COO)2]2·2H2O(摩尔质量376g/mol)是一种氧气吸收剂,红棕色晶体,易被氧化;易溶于盐酸,微溶于乙醇,难溶于水和乙醚。其制备装置(已省略加热及支持装置)和步骤如下:
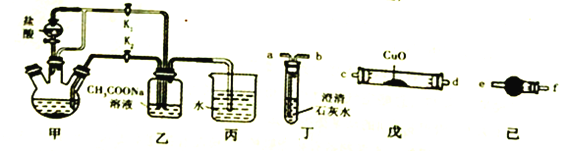
I.组装实验仪器后,首先进行必要的操作A。
II.往三颈烧瓶中依次加入过量锌粒、适量CrCl3溶液,再往其它仪器中加入相应的药品。
III.关闭K2,打开K1,旋开分液漏斗的旋塞并控制好滴速。
IV.待三颈烧瓶内的溶液由深绿色(Cr3+)变为亮蓝色(Cr2+)时,把溶液自动转移到装置乙中,当出现大量红棕色晶体时,关闭分液漏斗旋塞。
V.将装置乙中混合物快速过滤、洗涤和干燥,称量。
回答下列问题:
(1)步骤I中“操作A”为_____________;装置丙中导管口水封的目的主要是_________________________________。
(2)三颈烧瓶中的锌除与盐酸反应外,另发生的一个反应的化学方程式为_______________。
(3)步骤IV中溶液自动转移至装置乙中的实验操作为_______________;生成红棕色晶体的离子反应方程式____________________________。
(4)为得到纯净干燥的产品,洗涤时按使用的先后顺序选用下列洗涤剂__________(填序号)。
①乙醚②蒸馏水(煮沸冷却) ③无水乙醇 ④盐酸
(5)一定条件下[Cr(CH3COO)2]2·2H2O受热反应得到的气态产物含CO、CO2。请从丁、戊、己装置中选取必要装置检验这两种气体(不考虑尾气处理):
气态产物→_______________________→a(填接口字母序号)。
(6已知实验所用到的试剂中,CrCl3溶液中含溶质19.02g,0.1mol/L醋酸钠溶液为1.6L,其它反应物足量。实验后得到纯净干燥的[Cr(CH3COO)2]2·2H2O晶体11.28g,则该实验所得产品的产率为________(结果保留2位有效数字)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com