
| A. | 周期表中所有的族都是由长、短周期的元素共同组成 | |
| B. | 最外层电子数相同的元素不一定都是同一族 | |
| C. | 非金属元素都是主族元素,金属元素都是副族元素 | |
| D. | 元素周期表中共有18个纵行,每个纵行都是一个族,共有18个族 |
科目:高中化学 来源: 题型:选择题
| A. | 蛋白质、棉花、PVC、淀粉都是混合物 | |
| B. | 废弃的玻璃、金属、纸制品是可回收利用的资源 | |
| C. | 铁在潮湿的空气中放置,易发生化学腐蚀而生锈 | |
| D. | 用CO2合成聚碳酸酯可降解塑料,实现“碳”的循环利用 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
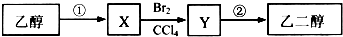
| A. | 步骤①的反应类型是氧化反应 | |
| B. | 等物质的量的乙醇、乙二醇完全燃烧,消耗氧气的量相同 | |
| C. | 1 mol乙二醇与乙酸若完全发生酯化反应,理论上可以增重120g | |
| D. | X可以使酸性高锰酸钾溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
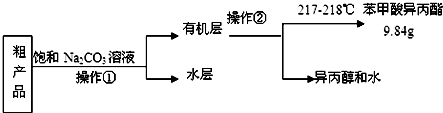
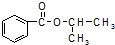 ),已知有关物质的沸点如表:
),已知有关物质的沸点如表:| 物质 | 异丙醇 | 苯甲酸 | 苯甲酸甲酯 |
| 沸点/℃ | 82.4 | 249 | 218 |
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.2mol | B. | 1mol | C. | 1.6mol | D. | 2mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
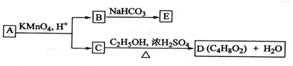
| A. | B的结构简式为HOOC-CH2-COOH | |
| B. | C与乙醇发生了酯化反应 | |
| C. | A的结构简式是CH3-CH(OH)-CH=CH-CH3 | |
| D. | E的分子式为C3H2O4Na2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
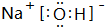 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸氢钠溶液与少量氢氧化钙溶液混合:2HCO3-+Ca2++2OH-═CaCO3↓+2H2O+CO32- | |
| B. | 用石墨做电极电解硫酸铜溶液:2Cu2++2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+4H+ | |
| C. | 向FeBr2溶液中通入等量的Cl2:2Br-+2Fe2++2Cl2═Br2+2Fe3++4Cl- | |
| D. | 向硫酸铝溶液中加入过量的氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com