
将35.8 g Al、Fe、Cu组成的合金溶于足量的NaOH溶液中,产生6.72L气体(标准状况)。另取等质量的该合金溶于过量的稀硝酸中,生成13.44 LNO(标准状况),向反应后的溶液中加入足量的NaOH溶液,得到沉淀的质量为
A. 66.4 g B.50.8 g C 44.8g D. 39.2 g
【知识点】氧化还原反应中的规律 B3
【答案解析】B 解析:合金溶于足量的NaOH溶液中,金属铝和氢氧化钠反应产生气体氢气6.72L(标准状况),物质的量为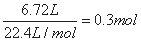 ,根据电子转移守恒可知n(Al)=0.2mol,故金属铝的质量为0.2mol×27g/mol=5.4g,金属铝提供电子的量是0.6mol,将合金溶于过量稀硝酸中,分别生成Al3+、Fe3+、Cu2+离子,根据电子守恒,金属共提供电子的物质的量为
,根据电子转移守恒可知n(Al)=0.2mol,故金属铝的质量为0.2mol×27g/mol=5.4g,金属铝提供电子的量是0.6mol,将合金溶于过量稀硝酸中,分别生成Al3+、Fe3+、Cu2+离子,根据电子守恒,金属共提供电子的物质的量为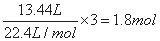 ,故Fe、Cu共提供的电子物质的量为1.8mol-0.6mol=1.2mol,向反应后的溶液中加入过量的NaOH溶液,所得沉淀为氢氧化铁、氢氧化铜,由电荷守恒可知,反应中金属铁、铜提供的电子的物质的量等于生成碱的氢氧根离子的物质的量,即n(OH-)=1.2mol,所以反应后沉淀的质量等于35.8g-5.4g+1.2mol×17g/mol=50.8g,
,故Fe、Cu共提供的电子物质的量为1.8mol-0.6mol=1.2mol,向反应后的溶液中加入过量的NaOH溶液,所得沉淀为氢氧化铁、氢氧化铜,由电荷守恒可知,反应中金属铁、铜提供的电子的物质的量等于生成碱的氢氧根离子的物质的量,即n(OH-)=1.2mol,所以反应后沉淀的质量等于35.8g-5.4g+1.2mol×17g/mol=50.8g,
【思路点拨】本题考查利用守恒方法进行简便计算,判断金属提供的电子的物质的量等于氢氧根的物质的量是该方法的关键,注意计算中守恒思想的运用.


科目:高中化学 来源: 题型:
营养品和药品都是保证人类健康不可缺少的物质,其性质和制法是化学研究的主要内容。
已知酪氨酸是一种生命活动不可缺少的氨基酸,它的结构简式是:
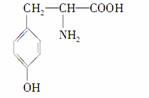
(1)酪氨酸能发生的化学反应类型有________。
A.取代反应 B.氧化反应
C.酯化反应 D.中和反应
(2)已知氨基酸能与碱反应,写出酪氨酸与足量的NaOH溶液反应的化学方程式:________________________________________________________________________
________________________________________________________________________。
(3)写出酪氨酸自身反应形成二肽的方程式:
________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
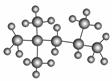
辛烷值常用来表示汽油的质量,汽油中异辛烷的爆震程度最小,一般将其辛烷值标定为100。如图是异辛烷分子的球棍模型,则异辛烷的系统命名为( )
A.1,1,3,3四甲基丁烷 B.2,2,4三甲基戊烷
C.2,4,4三甲基戊烷 D.2,3,4三甲基戊烷
查看答案和解析>>
科目:高中化学 来源: 题型:
向100mL的FeBr2溶液中,通入标准状况下Cl2 5.04L,Cl2全部被还原,测得溶液中c(Br-)=c(Cl-),则原FeBr2溶液的物质的量浓度是
A.0.75mol/L B.1.5mol/L C.2mol/L D.3mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
工业废水中常含有一定量的Cr2O 和CrO
和CrO ,它们会对生态系统造成很大的损害,其中还原沉淀法是常用的一种处理方法。流程如下:
,它们会对生态系统造成很大的损害,其中还原沉淀法是常用的一种处理方法。流程如下:
CrO
 Cr2O
Cr2O
 Cr3+
Cr3+ Cr(OH)3↓
Cr(OH)3↓
其中第①步中存在平衡:2CrO (黄色)+2H+
(黄色)+2H+ Cr2O
Cr2O (橙色)+H2O。下列有关说法正确的是
(橙色)+H2O。下列有关说法正确的是
A、第①步当2v(Cr2O )=v(CrO
)=v(CrO )时,达到了平衡状态
)时,达到了平衡状态
B、对于上述平衡,加入适量稀硫酸后,溶液颜色变黄色,则有利于CrO 的生成
的生成
C、常温下,Cr(OH)3的溶度积Ksp=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至9
D、第②步中,还原0.1 mol Cr2O 需要91.2 g FeSO4
需要91.2 g FeSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
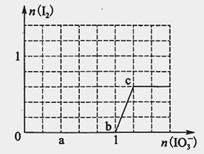
已知溶液中:还原性HSO3->I-,氧化性IO3->I2>SO42-。向含3 mol NaHSO3的溶液中逐滴加入KIO3溶液,加入的KIO3和析出的I2的物质的量的关系曲线如图所示,试回答下列问题:
(1)写出a点反应的离子方程式________________;反应中还原剂是______________;被还原的元素是__。
(2)写出b点到c点反应的离子方程式_____________________________。
(3)若往100 mL 1 mol·L-1的KIO3溶液中滴加NaHSO3溶液,反应开始时的离子方程式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
、同位素示踪法可用于反应机理的研究,下列反应或转化中同位素示踪表示正确的是 ( )
A.2Na218O2 + 2H2O = 4Nal8OH + O2↑
B.NH4Cl + 2H2O  NH3·2H2O + HCl
NH3·2H2O + HCl
C.2KMnO4 + 5H218O2 + 3H2SO4= K2SO4 + 2MnSO4 + 518O2↑ + 8H2O
D.K37ClO3 + 6HCl = K37Cl + 3Cl2↑ + 3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
向CuSO4溶液中逐滴加入KI溶液至过量,观察到产生白色沉淀CuI,蓝色溶液变为棕色。再向反应后的溶液中通入过量的SO2气体,溶液变成无色。则下列说法正确的是( )
A.通入22.4 L SO2参加反应时,有2 NA个电子发生转移
B.通入SO2后溶液逐渐变成无色,体现了SO2的漂白性
C.滴加KI溶液时,KI被氧化,CuI是氧化产物
D.上述实验条件下,物质的氧化性:Cu2+>I2>SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
将海水淡化与浓海水资源化结合起来是综合利用海水的重要途径之一。一般是先将海水淡化获得淡水,再从剩余的浓海水中通过一系列工艺流程提取其他产品。
回答下列问题:
(1)下列改进和优化海水综合利用工艺的设想和做法可行的是________(填序号)。
①用混凝法获取淡水 ②提高部分产品的质量
③优化提取产品的品种 ④改进钾、溴、镁等的提取工艺
(2)采用“空气吹出法”从浓海水吹出Br2,并用纯碱吸收。溴歧化为Br-和BrO 并没有产生CO2则反应的离子反应方程式为 。
并没有产生CO2则反应的离子反应方程式为 。
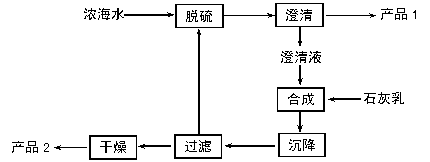
(3)海水提镁的一段工艺流程如下图:
 |
浓海水的主要成分如下:
| 离子 | Na+ | Mg2+ | Cl- | SO |
| 浓度/(g·L-1) | 63.7 | 28.8 | 144.6 | 46.4 |
该工艺过程中,脱硫阶段主要反应的阳离子_________,获得产品2的离子反应方程式为 ,浓海水的利用率为90%,则1L浓海水最多可得到产品2的质量为________g。
(4)由MgCl2·6H2O制备MgCl2时,往往在HCl的气体氛围中加热。其目的是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com