
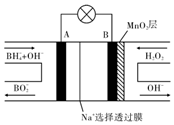
 新型$\frac{NaB{H}_{4}}{{H}_{2}{O}_{2}}$燃料电池(DBFC)的结构如图所示,该电池总反应方程式:NaBH4+4H2O2═NaBO2+6H2O,有关的说法不正确的是( )
新型$\frac{NaB{H}_{4}}{{H}_{2}{O}_{2}}$燃料电池(DBFC)的结构如图所示,该电池总反应方程式:NaBH4+4H2O2═NaBO2+6H2O,有关的说法不正确的是( )| A. | 纳米MnO2层的作用是提高原电池的工作效率 | |
| B. | 放电过程中,Na+从B极区移向A极区 | |
| C. | 电池负极的电极反应为:BH4+8OH--8e一═BO2-+6H2O | |
| D. | 在电池反应中,每消耗1L 1mol/L H2O2溶液,理论上流过电路中的电子为2 mol |
分析 由工作原理装置图可知,负极发生氧化反应,电极反应式为BH4-+8OH--8e-=BO2-+6H2O,正极H2O2发生还原反应,得到电子被还原生成OH-,电极反应式为H2O2+2e-=2OH-,再结合离子移动方向分析判断.
解答 解:A.电极B材料中包含MnO2层,二氧化锰能促进双氧水分解,所以MnO2可起催化作用,故A正确;
B.原电池工作时,阳离子向正极移动,则Na+从A极区移向B极区,故B错误;
C.负极发生氧化反应,电极反应式为BH4-+8OH--8e-=BO2-+6H2O,故C正确;
D.在电池反应中,每消耗1L 1mol/L H2O2溶液,理论上流过电路中的电子数为1mol/L×1L×2=2mol,故D正确.
故选B.
点评 本题考查了原电池原理,根据微粒中化合价变化确定正负极,再结合元素化合价变化、离子移动方向等知识点分析解答,难点是电极反应式书写,题目难度不大.


 走进文言文系列答案
走进文言文系列答案科目:高中化学 来源: 题型:选择题
| A. | X为0.05 mol•L-1 | B. | Y为0.1 mol•L-1 | C. | Z为0.2 mol•L-1 | D. | W为0.1 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 “天宫一号”的供电系统中有再生氢氧燃料电池(RFC),RFC是一种将太阳能电池电解水技术与氢氧燃料电池技术相结合的可充电电池.下图为RFC工作原理示意图(隔膜为质子选择性透过膜),下列说法中正确的是( )
“天宫一号”的供电系统中有再生氢氧燃料电池(RFC),RFC是一种将太阳能电池电解水技术与氢氧燃料电池技术相结合的可充电电池.下图为RFC工作原理示意图(隔膜为质子选择性透过膜),下列说法中正确的是( )| A. | c极上发生的电极反应是:O2+4H++4e-═2H2O | |
| B. | 当有0.1mol电子转移时,b极产生1.12L 气体Y(标准状况下) | |
| C. | 装置I与装置II的电解质溶液中,氢离子运动方向相反 | |
| D. | RFC系统工作过程中只存在3种形式的能量转化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 钠硫电池是一种新型可充电电池,它以熔融的金属钠作为电极的反应物,以熔融的硫和多疏化钠(Na2Sx,熔融状态下可电离出Na,和S42-的混合物作一个电极的反应物,以固体Al2O3陶瓷(可传导Na,但不能传导阴离子)为电解质,电池总反应为2Na+xS═Na2Sx.工作原理如图所示:
钠硫电池是一种新型可充电电池,它以熔融的金属钠作为电极的反应物,以熔融的硫和多疏化钠(Na2Sx,熔融状态下可电离出Na,和S42-的混合物作一个电极的反应物,以固体Al2O3陶瓷(可传导Na,但不能传导阴离子)为电解质,电池总反应为2Na+xS═Na2Sx.工作原理如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2的电子式为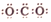 | |
| B. | 浓H2SO4试剂瓶上应贴上危险警告标签 | |
| C. | 根据分散质微粒直径大小,可将分散系分为浊液,胶体和溶液 | |
| D. | 核内打8个中子的碳原子可表示为86C |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 甲烷、一氧化碳和氢气、甲醇等既是重要的燃料也是重要的化工原料.已知:
甲烷、一氧化碳和氢气、甲醇等既是重要的燃料也是重要的化工原料.已知:| 化学键 | C-C | C-H | H-H | C-O | C≡O | H-O |
| 键能 (kJ•mol-1) | 348 | 413 | 436 | 358 | 1072 | 463 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Ksp(AB2)<Ksp(CD),说明AB2的溶解度小于CD的溶解度 | |
| B. | 在ZnS的沉淀溶解平衡体系中加入蒸馏水,ZnS的Ksp不变 | |
| C. | 已知Ksp(AgCl)>Ksp(AgI),则反应AgCl(s)+I-(aq)=AgI(s)+Cl-(aq)能够发生 | |
| D. | 在CaCO3的沉淀溶解平衡体系中加入稀盐酸,沉淀溶解平衡不移动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com