
| A. | 在酸性条件下,CH3CO18OC2H5的水解产物是CH3CO18OH和C2H5OH | |
| B. | 用甘氨酸和丙氨酸缩合最多可形成4种二肽 | |
| C. | 分子式为C5H8O2,既能与Na2CO3溶液反应又能与溴的四氯化碳溶液反应的有机物有8种 | |
| D. | 乳酸薄荷醇酯(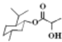 )能发生水解、氧化、消去反应 )能发生水解、氧化、消去反应 |
分析 A.CH3CO18OC2H5的水解产物是CH3COOH和C2H518OH;
B.氨基酸形成肽键原理为羧基提供-OH,氨基提供-H,两个氨基酸分子脱去一个水分子脱水结合形成二肽,既要考虑不同氨基酸分子间生成二肽,又要考虑同种氨基酸分子间形成二肽;
C.能与Na2CO3,溶液反应生成CO2,说明此分子含有羧基,能与溴的四氯化碳溶液反应说明此分子含有碳碳双键,然后根据官能团的位置异构和碳链异构确定;
D.含-COOC-可发生水解,含-OH可发生氧化、消去反应.
解答 解:A.酯化反应原理为酸脱羟基醇脱氢,在酸性条件下,CH3CO18OC2H5的水解产物是CH3COOH和C2H518OH,故A错误;
B.氨基酸生成二肽,就是两个氨基酸分子脱去一个水分子.当同种氨基酸脱水,生成2种二肽;当是异种氨基酸脱水:可以是甘氨酸脱去羟基,丙氨酸脱氢;也可以丙氨酸脱羟基,甘氨酸脱去氢,生成2种二肽,共4种,故B正确;
C.能与Na2CO3,溶液反应生成CO2,说明此分子含有羧基,能与溴的四氯化碳溶液反应说明此分子含有碳碳双键,根据碳链异构和双键、羧基官能团异构可得8种同分异构体,分别为: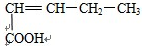 、
、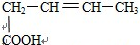 、
、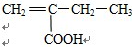 、
、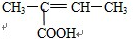 、
、 、
、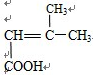 、
、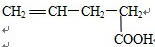 、
、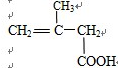 ,故C正确;
,故C正确;
D. 分子中含-COOC-可发生水解反应,含-OH可发生氧化反应、消去反应,故D正确;
分子中含-COOC-可发生水解反应,含-OH可发生氧化反应、消去反应,故D正确;
故选A.
点评 本题考查了有机物结构与性质,题目难度中等,注意掌握常见有机物结构与性质,明确酯化反应原理,C为难点、易错点,注意掌握同分异构体的概念及书写原则,避免重复或遗漏现象.


科目:高中化学 来源: 题型:选择题
| A. | 依次使用Na2CO3溶液和盐酸,可除去锅炉水垢中的CaSO4 | |
| B. | 草木灰溶液能够去除油污 | |
| C. | 低血糖症状出现时,吃馒头要比喝葡萄糖水见效快 | |
| D. | 若发生液氨泄漏,人应尽量往上风向处较低的位置转移 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 气体 | CO | N2 | CO2 | H2 | O2 |
| 体积(m3)(标准状况) | x | 20 | 12 | 60 | 1.0 |
| 化学式 | H2CO3 | HClO | H2C4H4O6(酒石酸) |
| 电离平衡常数 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 | K1=9.1×10-4 K2=4.3×10-5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 四种元素A、B、C、D分别为O、Ca、Na、Ar | |
| B. | 元素A、B、C两两组成的化合物可为CaO、CaO2、Na2O、Na2O2等 | |
| C. | 元素A、C简单离子的半径大小关系为A<C | |
| D. | 元素B、C的单质与水都能剧烈反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ① | B. | ①③ | C. | ②③④⑤⑥⑦ | D. | ①③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol聚乙烯含有的原子数目为6NA | |
| B. | 标准状况下,11.2L CHCl3中所含有的原子总数为2.5NA | |
| C. | 一定条件下,2.6 g乙炔、苯的气态混合物中所含碳原子数为0.2NA | |
| D. | 1 mol甲基与1mol羟基所含电子数均为10 NA个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 烧杯①中,若构成微型电池,负极反应式为2Al-6e-=2Al3+,正极反应式为 6H++6e-=3H2↑ | |
| B. | 烧杯①中,若将电解质溶液换成浓硝酸,构成微型电池时铝为负极,铜为正极 | |
| C. | 烧杯②中,若铁、铜构成微型电池,则铁为负极;若铝、铁构成微型电池,则铁为正极 | |
| D. | 烧杯②中,固体最终完全溶解,溶液呈蓝色.向溶液中滴加KSCN溶液,溶液不变色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com