
(10分)合成氨反应原理为:N2(g)+3H2(g)  2NH3(g) ΔH=-92.4 kJ·mol-1 一种工业合成氨的简易流程图如下:
2NH3(g) ΔH=-92.4 kJ·mol-1 一种工业合成氨的简易流程图如下:
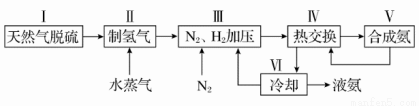
(1)步骤Ⅱ中制氢气原理如下:
①CH4(g)+H2O(g)  CO(g)+3H2(g) ΔH=+206.4 kJ·mol-1
CO(g)+3H2(g) ΔH=+206.4 kJ·mol-1
②CO(g)+H2O(g)  CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1
CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1
对于反应①,一定可以提高平衡体系中H2百分含量,又能加快反应速率的措施是 ________。
a.升高温度 b.增大水蒸气浓度 c.加入催化剂 d.缩小容器的体积
利用反应②,将CO进一步转化,可提高H2产量。若2 mol CO和H2的混合气体(CO的体积分数为20%)与H2O反应,得到2.2 mol CO、CO2和H2的混合气体,则CO转化率为________。
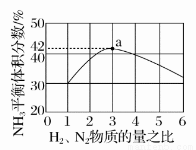
(2)图中表示500℃、60.0 MPa条件下,原料气投料比与平衡时NH3体积分数的关系。根据图中a点数据计算H2的平衡体积分数:________。
(3)上述流程图中,使合成氨放出的能量得到充分利用的主要步骤是(填序号)________。简述两点本流程中提高合成氨原料总转化率的方法:_______________________________________。
(1) a 50% (2) 43.5% (3)Ⅳ 对原料气加压;分离液氨后,未反应的N2、H2循环使用
【解析】
试题分析:对于反应①加快反应速率的措施有升高温度、增大压强、增大物质浓度、加入催化剂;提高平衡体系中H2百分含量的措施有升高温度、减小压强,增大水蒸气浓度有可能使H2百分含量增大,也可能减小,故对于反应①,一定可以提高平衡体系中H2百分含量,又能加快反应速率的措施是升高温度;利用反应②,将CO进一步转化,可提高H2产量。若2 mol CO和H2的混合气体(CO的体积分数为20%)与H2O反应,可知原来混合气体中存在CO为0.4mol,反应后得到2.2 mol CO、CO2和H2的混合气体,可知反应后混合气体中CO2生成了0.2mol,则CO转化量为0.2mol,CO转化率为50%;图中表示500℃、60.0 MPa条件下,原料气投料比与平衡时NH3体积分数的关系,图中a点数据投料比为3,等于反应系数比,则平衡时N2、H2的体积分数比为1:3,NH3的体积分数为42%,可得H2的平衡体积分数为(1-42%)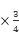 =43.5%;上述流程图中能量的综合利用为第Ⅳ步中热交换利用废热加热气体,通过流程图可知本流程中提高合成氨原料总转化率的方法对原料气加压;分离液氨后,未反应的N2、H2循环使用等。
=43.5%;上述流程图中能量的综合利用为第Ⅳ步中热交换利用废热加热气体,通过流程图可知本流程中提高合成氨原料总转化率的方法对原料气加压;分离液氨后,未反应的N2、H2循环使用等。
考点:简易工艺流程与化学反应原理综合题。


科目:高中化学 来源:2014-2015学年河南鄢陵县第一高中高一上第一次考试化学(B)试卷(解析版) 题型:选择题
与50 mL 0.1 mol/L Na2CO3 溶液中 Na+ 的物质的量浓度相同的溶液是( )
A.50mL 0.2mol/L的NaCl溶液 B.100mL 0.1mol/L的NaCl溶液
C.25mL 0.2mol/L的Na2SO4溶液 D.10mL 0.5mol/L的Na2CO3溶液
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南郑州市高一上10月月考化学试卷(解析版) 题型:选择题
矿泉水是人们居家旅游常用的饮料,市场上有些不法商贩为牟取暴利,用自来水(用氯气消毒)冒充矿泉水出售。为辨别真伪,可用下列的一种化学试剂来鉴别,该试剂是( )
A.酚酞试液 B.氯化钡溶液
C.氢氧化钠溶液 D.硝酸银溶液
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省高一上第二次考试化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数,下列说法中正确的是( )。
A.1NA个氢气分子所占的体积为22.4 L
B.2NA个二氧化碳分子的质量为88 g
C.0.1 mol/L 的NaCl溶液中,Na+与Cl-离子总数为0.2NA
D.17 g NH3中所含原子数为NA
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省高一上第二次考试化学试卷(解析版) 题型:选择题
下列关于容量瓶及其使用方法的叙述正确的是( )。
①容量瓶是配制一定物质的量浓度的溶液的专用仪器 ②容量瓶使用前要先检查容量瓶是否漏液 ③容量瓶可以用来加热 ④容量瓶不能用长期贮存配制好的溶液 ⑤一定要用500mL容量瓶配制250mL溶液
A.①③ B.①②④⑤ C. ①②④ D.①②③④
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省高二上学期期中化学试卷(解析版) 题型:选择题
某原电池装置如图所示,电池总反应为2Ag+Cl2===2AgCl。下列说法正确的是
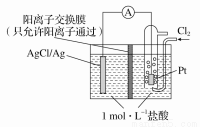
A.当电路中转移0.1 mol e-时,交换膜左侧溶液中约减少0.2 mol离子
B.放电时,交换膜两侧溶液中均有大量白色沉淀生成
C.若用NaCl溶液代替盐酸,则电池总反应随之改变
D.正极反应为AgCl+e-===Ag+Cl-
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省高二上学期期中化学试卷(解析版) 题型:选择题
在一定温度下,反应AB(g) 
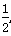 A2(g)+
A2(g)+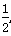 B2(g)的平衡常数为0.1 。若将1.0 mol的AB(g)通入体积为1.0 L的密闭容器中,在该温度时AB(g)的最大分解率接近于
B2(g)的平衡常数为0.1 。若将1.0 mol的AB(g)通入体积为1.0 L的密闭容器中,在该温度时AB(g)的最大分解率接近于
A.5% B.17% C.25% D.33%
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省高一上学期期中化学试卷(解析版) 题型:选择题
下列各组中的离子,能在溶液中大量共存的是
A.Na+、H+、SO42-、OH-
B.K+、Ca2+、CO32-、NO3-
C.Na+、H+、Cl-、CO32-
D.K+、Cu2+、Cl-、SO42-
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省洛阳市高一10月月考化学试卷(解析版) 题型:填空题
将标准状况下22.4 L的HCl溶于水配成200 mL的溶液,所得溶液的物质的量浓度为_____mol/L;配制300 mL 0.5 mol·L-1氯化钠溶液,需要1.5 mol·L-1的氯化钠溶液的体积是________mL。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com