
| △c |
| △t |
| n |
| V |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1mol×3 |
| 2 |
| 1mol×1 |
| 2 |
| 3mol |
| 2L |
| ||
| 5min |


科目:高中化学 来源: 题型:
| A、强碱性溶液中:Na+、CO32-、SO32-、K+ |
| B、石蕊呈红色的溶液:ClO-、Na+、SO32-、Cl- |
| C、PH>7的溶液中:Mg2+、Br-、K+、Al3+ |
| D、加入Fe能放出H2的溶液中:Cl-、Mg2+、SO42-、K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
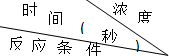 | 30%H2O2 | 15%H2O2 | 10%H2O2 | 5%H2O2 |
| 无催化剂、不加热 | 几乎不反应 | 几乎不反应 | 几乎不反应 | 几乎不反应 |
| 无催化剂、加热 | 360 | 480 | 540 | 720 |
| MnO2催化剂、加热 | 10 | 25 | 60 | 120 |
查看答案和解析>>
科目:高中化学 来源: 题型:
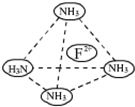 物质结构与性质A、B、C、D、E为原子序数依次增大的六种元素.已知:A是周期表中原子半径最小的元素,B的基态原子2p原子轨道上有3个未成对的电子,且B、C、E三种元素原子中未成对电子数之比为3:2:1,D原子核外有4个能级且均充满电子,D与E可形成DE2型化合物,F原子核外最外层只有1个电子,其余各层均充满电子.
物质结构与性质A、B、C、D、E为原子序数依次增大的六种元素.已知:A是周期表中原子半径最小的元素,B的基态原子2p原子轨道上有3个未成对的电子,且B、C、E三种元素原子中未成对电子数之比为3:2:1,D原子核外有4个能级且均充满电子,D与E可形成DE2型化合物,F原子核外最外层只有1个电子,其余各层均充满电子.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、证明一瓶红棕色气体是溴蒸气还是二氧化氮,可用湿润的碘化钾-淀粉试纸检验,观察试纸颜色的变化 |
| B、铝热剂溶于足量稀盐酸再滴加KSCN溶液,未出现血红色,铝热剂中一定不含铁的氧化物 |
| C、测氯水的pH,可用玻璃棒蘸取氯水点在pH试纸上,待其变色后和标准比色卡比较 |
| D、用浓硫酸吸收二氧化硫中混有少量SO3气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
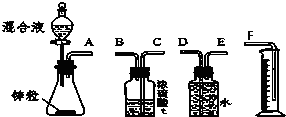 某学习小组在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率.为了进一步研究硫酸铜的浓度对氢气生成速率的影响,该小组同学开始了实验探究.
某学习小组在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率.为了进一步研究硫酸铜的浓度对氢气生成速率的影响,该小组同学开始了实验探究.| 混合溶液组成 | A组 | B组 | C组 | D组 | E组 | F组 |
| 4mol/LH2SO4 | 30mL | V1 mL | V2 mL | V3 mL | V4 mL | V5 mL |
| 饱和CuSO4溶液 | 0mL | 0.5mL | 2.5mL | 5mL | V6 mL | 20mL |
| H2O | V7 mL | V8 mL | V9 mL | V10 mL | 10mL | 0mL |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加入Al能放出H2的溶液中:Mg2+、Cu2+、SO42-、NO3- |
| B、能使酚酞变红的溶液中:K+、Na+、Cl-、CO32- |
| C、无色透明的水溶液中:K+、Ba2+、I-、MnO4- |
| D、常温下,在c(H+)/c(OH-)=1×10-12的溶液中:Fe2+、Cu2+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
 A、B、C、D、E是中学常见的5种化合物,A、B是氧化物,元素X、Y的单质是生活中常见的金属,相关物质间的关系如图所示.
A、B、C、D、E是中学常见的5种化合物,A、B是氧化物,元素X、Y的单质是生活中常见的金属,相关物质间的关系如图所示.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com