
【题目】实验室使用pH传感器来测定Na2CO3和NaHCO3混合物中NaHCO3的含量。称取1.59 g样品,溶于水配成250.00 mL溶液,取出该溶液25.00 mL用0.1 mol·L-1盐酸进行滴定,得到如下曲线。以下说法或操作正确的是( )
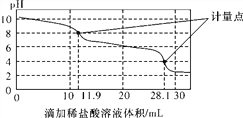
A. 上一个计量点前发生反应的离子方程式为HCO(+H+===H2O+CO2↑
B. 下一个计量点溶液中存在大量的阴离子是Cl-、HCO(
C. 此样品n(NaHCO3)=(28.1-2×11.9)×10-4 mol
D. 使用该方法测定Na2CO3和NaOH混合溶液中的氢氧化钠含量,将会得到1个计量点
【答案】C
【解析】A.根据图示知道上一个计量点前溶液显示碱性,发生的离子反应:CO32-+H+═HCO3-,故A错误;B.下一个计量点溶液pH=4,显示酸性,不能存在HCO3-离子,故B错误;C.Na2CO3和NaHCO3混合物加盐酸,首先是碳酸钠转化为碳酸氢钠:CO32-+H+═HCO3-,此时消耗的盐酸的体积为11.9mL,随后是碳酸氢钠转化为氯化钠的过程,HCO3-+H+═H2O+CO2↑,由于CO32-+H+═HCO3-过程和HCO3-+H+═H2O+CO2过程消耗的盐酸体积应该是相同的,所以样品中碳酸钠消耗的盐酸为2×11.9mL,则样品中碳酸氢钠消耗的盐酸n(HCl)=(28.1-2×11.9)×10-3L×0.1molL-1=(28.1-2×11.9)×10-4mol,所以此样品n(NaHCO3)=(28.1-2×11.9)×10-4mol×10=(28.1-2×11.9)×10-3mol,故C正确;D.Na2CO3和NaOH混合溶液中加入盐酸,先是和氢氧化钠中和,随后是和碳酸钠之间发生反应,生成碳酸氢钠,最后是生成氯化钠,不止得到1个计量点,是3个计量点,故D错误;故选C。


科目:高中化学 来源: 题型:
【题目】(1)0.5 mol的Fe含___________个铁原子(用6.02×1023表示阿伏加德罗常数),质量是_______g;
(2)2mol CO2中含______ mol碳原子__________个氧原子(以NA为阿伏加德罗常数的值),________个质子(以NA为阿伏加德罗常数的值),标准状况下的体积为___________L,质量是______________g。
(3)在标准状况下,体积为8.96 L的CO和CO2的混合气体共14.4 g,
①CO的质量为________
②混合气体的平均摩尔质量为________
③CO2的体积为________
④混合气体的密度为_____(小数点后保留1位)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[2017江苏]通过以下反应可获得新型能源二甲醚(CH3OCH3 )。下列说法不正确的是
①C(s) + H2O(g)![]() CO(g) + H2 (g) ΔH1 = a kJ·mol1
CO(g) + H2 (g) ΔH1 = a kJ·mol1
②CO(g) + H2O(g)![]() CO2 (g) + H2 (g) ΔH 2 = b kJ·mol1
CO2 (g) + H2 (g) ΔH 2 = b kJ·mol1
③CO2 (g) + 3H2 (g)![]() CH3OH(g) + H2O(g) ΔH 3 = c kJ·mol1
CH3OH(g) + H2O(g) ΔH 3 = c kJ·mol1
④2CH3OH(g)![]() CH3OCH3 (g) + H2O(g) ΔH 4 = d kJ·mol1
CH3OCH3 (g) + H2O(g) ΔH 4 = d kJ·mol1
A.反应①、②为反应③提供原料气
B.反应③也是CO2资源化利用的方法之一
C.反应CH3OH(g)![]()
![]() CH3OCH3 (g) +
CH3OCH3 (g) +![]() H2O(l)的ΔH =
H2O(l)的ΔH =![]() kJ·mol1
kJ·mol1
D.反应 2CO(g) + 4H2 (g)![]() CH3OCH3 (g) + H2O(g)的ΔH = ( 2b + 2c + d ) kJ·mol1
CH3OCH3 (g) + H2O(g)的ΔH = ( 2b + 2c + d ) kJ·mol1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:H2(g)+ F2(g)===2HF(g)的能量变化如图所示,下列有关叙述中正确的是( )

A. 氟化氢气体分解生成氢气和氟气的反应是放热反应
B. 1 mol H2与1 mol F2反应生成2 mol液态HF放出的热量小于270 kJ
C. 在相同条件下,1 mol H2与1 mol F2的能量总和大于2 mol HF气体的能量
D. 断裂1 mol H—H键和1 mol F—F键吸收的能量大于形成2 mol H—F键放出的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢能是重要的新能源。储氢作为氢能利用的关键技术,是当前关注的热点之一。
(1)可逆反应N2+3H2![]() 2NH3是工业上合成氨的重要反应
2NH3是工业上合成氨的重要反应

图1(图中表示生成1 mol物质时的能量)
根据图1请写出合成氨的热化学方程式:__________________(热量用E1、E2或E3表示)。
(2)LiAlH4是一种重要的储氢载体,能与水反应达到LiAlO2和氢气,该反应消耗1 mol LiAlH4时转移的电子数目为__________。
(3)氮化锂是非常有前途的储氢材料,其在氢气中加热时可得到氨基锂(LiNH2),其反应的化学方程式为:Li3N+2H2![]() LiNH2+2LiH,氧化产物为_________(填化学式),在270℃时,该反应可逆向发生放出H2,因而氮化锂可作为储氢材料,储存氢气最多可达Li3N质量的_____%(精确到0.1)。
LiNH2+2LiH,氧化产物为_________(填化学式),在270℃时,该反应可逆向发生放出H2,因而氮化锂可作为储氢材料,储存氢气最多可达Li3N质量的_____%(精确到0.1)。
(4)LiFePO4新型锂离子动力电池以其独特的优势成为奥运会绿色能源的新宠,已知电池放电时总反应式为FePO4+Li![]() LiFePO4 ,电池正极反应为____________________。
LiFePO4 ,电池正极反应为____________________。
(5)一定条件下,如图所示装置可实现有机物的电化学储氢(忽略其它有机物)。

①导线中电子移动方向为____________。(用A、D表示)
②生成目标产物的电极反应式为__________________________。
③该储氢装置的电流效率![]() =__________________________。
=__________________________。
(![]() =
=![]() ×100%,计算结果保留小数点后1位)
×100%,计算结果保留小数点后1位)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】大力发展电动汽车,可以有效控制空气污染。目前机动车常使用的电池有铅蓄电池、锂电池等。
I.铅蓄电池充放电的总反应为:PbO2+Pb+2H2SO4 ![]() 2PbSO4+2H2O,锂硫电池充放电的总反应为:2Li+S
2PbSO4+2H2O,锂硫电池充放电的总反应为:2Li+S![]() Li2S。
Li2S。
(1)82Pb的原子结构示意图为 。铅蓄电池的正极材料为_________。
(2)当消耗等质量的负极活性物质时,锂硫电池的理论放电量是铅蓄电池的 ____倍。(保留三位有效数字)。
(3)古代用PbSO4作油画的白色颜料,置于空气会慢慢变成黑色的PbS,从而使油画色彩变暗。用H2O2清洗可使油画“复原”。用化学方程式表示该复原的原理________。
II.由方铅矿(PbS)制备铅蓄电池电极材料(PbO2)的方法如下:
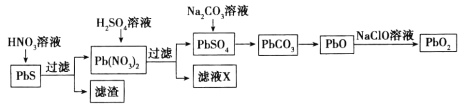
(4)滤液X是一种可循环使用的物质,其溶质主要是__________________(填化学式),若X中残留的![]() 过多,循环使用时可能出现的问题是___________________________。
过多,循环使用时可能出现的问题是___________________________。
(5)向 PbSO4中加Na2CO3溶液会发生:PbSO4 (s)+ ![]() (aq)
(aq)![]() PbCO3 (s)+
PbCO3 (s)+ ![]() (aq)。已知25℃时,Ksp(PbSO4)= 1.8×10-8,Ksp(PbCO3)=1.5×10-13。列式并计算该反应此温度下的平衡常数K 。(提示:需写出K的表达式、代入数据、算出结果)
(aq)。已知25℃时,Ksp(PbSO4)= 1.8×10-8,Ksp(PbCO3)=1.5×10-13。列式并计算该反应此温度下的平衡常数K 。(提示:需写出K的表达式、代入数据、算出结果)
(6)以石墨为电极电解Pb(NO3)2溶液也可以制得PbO2。PbO2将在 极生成(填“阴”或“阳”);而另一极的电极反应式为 ,故Pb元素的利用率较低。若在Pb(NO3)2溶液中加入适量Cu(NO3)2则可有效利用Pb2+,其理由是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 按系统命名法,化合物![]() 的名称为2, 4-二乙基-丙基辛烷
的名称为2, 4-二乙基-丙基辛烷
B. 若两种二肽互为同分异构体,则二者的水解产物一定不相同
C. 分子式为C5H5O2Cl并能与饱和NaHCO3溶液反应产生气体的有机物有(不含立休结构)有12种
D. 某有机物的结构简式是 ,该有机物能够发生加成反应、取代反应、缩聚反应和消去反应
,该有机物能够发生加成反应、取代反应、缩聚反应和消去反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取两份铝片,第一份与足量盐酸反应,第二份与足量烧碱溶液反应,同温同压下放出相同体积的气体,则两份铝片的质量之比为( )
A. 1:6 B. 2:3 C. 3:2 D. 1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C三种物质随着X的变化,Y发生相应的变化,其变化关系如图所示。

(1)若X表示的是物质的量,则Y表示的不可能是_____(填序号,下同)
①物质的量 ②物质的体积 ③物质所含分子或原子的数目 ④物质的摩尔质量
(2)若A、B、C均为气体且压强恒定时,X表示的是温度,则Y表示的可能是______。
①气体的质量 ②气体的分子数 ③气体的体积 ④气体的摩尔质量
(3)若A、B、C均为气体,Y表示在相同条件下气体的体积,X表示的是气体的质量。
①相同条件下A、B、C三种气体的密度由大到小的顺序是_____(用字母A、B、C表示,下同)。
②A、B、C三种气体的摩尔质量由大到小的顺序是__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com