
(16分)铜在自然界中存在于多种矿石中,如
| 矿石名称 | 黄铜矿 | 斑铜矿 | 辉铜矿 | 孔雀石 |
| 主要成分 |
|
|
|
|
请回答以下问题:
(1)上表所列铜的化合物中,铜的质量分数最高的是______________(填化学式)。
(2)工业上以黄铜矿为原料,采取火法熔炼工艺生产铜。该过程中有如下反应:
![]() ,该反应的还原剂是____________;若在标准状况下放出气体56L,则转移电子的物质的量为_____________。
,该反应的还原剂是____________;若在标准状况下放出气体56L,则转移电子的物质的量为_____________。
(3)某同学采集酸雨样品并测其pH,发现在一段时间内其pH逐渐减小。请用必要的文字和化学方程式说明其原因______________________________________________
________________________________________________________。
(4)铜制品长期置于潮湿的环境中,表面会产生一层铜绿,其主要成分与孔雀石相同。
请写出采用化学方法除去铜器表面铜绿的有关反应的离子方程式:_____________
_______________________________________________。
(5)![]() 与
与![]() 都是红色粉末。
都是红色粉末。![]() 溶于稀
溶于稀![]() 会生成
会生成![]() 和
和![]() 。一同学为鉴定某
。一同学为鉴定某![]() 样品中是否混有多少量的
样品中是否混有多少量的![]() ,设计了如下实验:取少量粉末放入足量稀
,设计了如下实验:取少量粉末放入足量稀![]() 中,向所得溶液中滴加
中,向所得溶液中滴加![]() 试剂。该同学通过实验认为:若滴加KSCN试剂后溶液不变红色,则证明原固体粉末中一定不含
试剂。该同学通过实验认为:若滴加KSCN试剂后溶液不变红色,则证明原固体粉末中一定不含![]() 。你认为这种说法是否正确___________:简述你的理由(用离子方程式表示):______________,
。你认为这种说法是否正确___________:简述你的理由(用离子方程式表示):______________,
如果要得到准确的结论,还需加入的一种试剂是_________________。
科目:高中化学 来源: 题型:阅读理解

| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、分子间作用力比化学键弱得多 | B、溶液通常是澄清透明的,胶体通常是浑浊的 | C、铁和铜在自然界中只能以化合态形式存在 | D、防止酸雨的最根本途径是减少温室气体的排放 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
(1)氯气是最早用于饮用水消毒的物质,其消毒作用主要是氯气溶于水后生成了次氯酸,该反应的离子方程式为__________________,多余的氯气可用绿矾吸收,反应的离子方程式为____________________________________________________________________。
(2)氯气用于自来水消毒除有异味外,近来发现能产生500多种有致癌、致畸作用的有机氯衍生物,如CHCl3、CCl2Br2等。写出CH4与Cl2反应生成CHCl3的化学方程式:
__________________;__________________;__________________。
以上反应均属于_________反应(填有机反应类型),由此可知,每生成1 mol CHCl3,消耗Cl2的物质的量_________ (填“大于”“等于”或“小于”)3 mol。
(3)用高铁酸钠(Na2FeO4)对来自河、湖的淡水消毒是城市饮用水处理新技术,下列对Na2FeO4能用于饮用水消毒和净化处理的原因分析正确的是( )
A.Na2FeO4在溶液中显强碱性,能消毒杀菌
B.Na2FeO4的还原产物是Fe3+,易水解生成Fe(OH)3,可使水中悬浮物凝聚沉降
C.Na2FeO4的还原产物是Fe2+,易水解为Fe(OH)2,可使水中悬浮物凝聚?沉降
D.Na2FeO4中Fe为+6价,具有强氧化性,能消毒杀菌
高铁(Ⅵ)酸盐是新一代水处理剂,其制备方法有次氯酸盐氧化法(湿法):该法是在碱性溶液中,利用次氯酸盐氧化三价铁盐,试写出并配平这一离子反应方程式:__________________。
(4)我国南方某些地区的井水取来久置后,由澄清透明变成有少量棕红色絮状沉淀沉积于缸底,水面浮着一层“锈皮”,当地居民常采用加明矾的方法处理。①井水久置后,水面浮着的一层“锈皮”的主要成分是_________(写化学式)。②用化学方法鉴别该井水的步骤是__________________;离子方程式是__________________。③用化学方法鉴别经明矾处理后的水的步骤是__________________;离子方程式是__________________。④AlCl3·6H2O(代号AC)和[Al2(OH)nCl6-n]m(代号BAC)都可以作为水澄清剂。它们对水的pH改变的影响是否一样大?_________;原因是什么?__________________。
(5)X物质也可用于自来水消毒,既能提高消毒效率,又安全、无异味、无副作用,该物质在自然界中存在,对地球生物起保护伞作用。X的化学式是_________。X能使湿润的淀粉碘化钾试纸变蓝,试写出该反应的化学方程式:__________________。该反应过程中氧化产物和还原产物的物质的量之比为_________。
(6)ClO2被称为“第四代”饮用水杀菌剂,因其高效、无污染而被广泛使用。我国北京永利科技有限公司已用电解法批量生产ClO2。其反应原理为![]() +4 H+
+4 H+![]() 4ClO2↑+O2↑+2H2O,从反应原理看,应在酸性条件下进行,能否用盐酸调节溶液的酸性?
4ClO2↑+O2↑+2H2O,从反应原理看,应在酸性条件下进行,能否用盐酸调节溶液的酸性?
答:________(填“能”或“不能”),理由是________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
肉桂醛(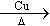 )在自然界中存在于桂油中,是一种常用的植物调味油,工业主要用CH2=CH2和甲苯为主要原料进行合成:
)在自然界中存在于桂油中,是一种常用的植物调味油,工业主要用CH2=CH2和甲苯为主要原料进行合成:
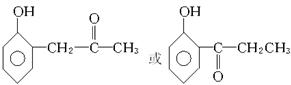
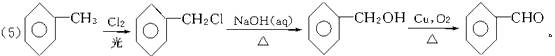
请回答:
(1)E中含氧官能团的名称是_____________________。
(2)反应①—④中属于加成反应的是____________________________________。
(3)反应②的化学方程式是____________________________________。
(4)写出符合下列要求的E的同分异构体的结构简式(写出一种即可)__________________。
a.遇FeCl3溶液显紫色
b.苯环上有两个取代基
c.不能发生银镜反应
d.除苯环外不存在其他的环状结构
e.不存在C=C
(5)用流程图表示出由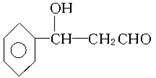 制备
制备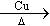 的方案,例如:
的方案,例如:
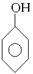 。
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com