
| A. | 物质的量是一个基本物理量,表示物质所含粒子的多少 | |
| B. | 1mol氢中含有2mol氢原子和2mol电子 | |
| C. | 1molH2O的质量等于NA 个H2O 分子的质量总和 | |
| D. | 硫酸的摩尔质量是98g |
分析 A.物质的量是一个基本物理量,表示含有一定数目粒子集体的物理量;
B.物质的量是表示微观粒子的物理量需要指明微粒种类;
C.1molH2O的质量等于NA个H2O物质的量为1molH2O的质量的总和;
D.摩尔质量的单位为g/mol.
解答 解:A.“物质的量是一个基本物理量”是对的,但物质的量不是表示物质所含“粒子的多少”,而是表示物质所含“一定数目粒子的集合体”的多少,故A错误;
B.“1 mol氢”没有指出具体微粒是什么,故B错误;
C.1 mol H2O中含NA个水分子,1 mol H2O的质量就等于NA个H2O分子质量的总和,故C正确;
D.硫酸的摩尔质量为98g/mol,故D错误;
故选C.
点评 本题考查了物质的量的应用,题目难度不大,明确摩尔质量与质量、物质的量与微粒数之间的关系为解答关键,试题侧重基础知识的考查,有利于提高学生的灵活应用能力.


科目:高中化学 来源:2016-2017学年河北省高二上第一次月考化学试卷(解析版) 题型:选择题
下列事实不能用勒夏特列原理解释的是( )
A.向氯水中加食盐不利于氯气的溶解
B.棕红色NO2加压后颜色先变深后变浅
C.SO2催化氧化成SO3的反应,往往需要使用催化剂
D.高压有利于合成氨的反应
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省唐山市高二上10月月考化学试卷 (解析版) 题型:选择题
下列说法中正确的是( )
A.凡是放热反应都是能自发进行的反应,而吸热反应都是非自发进行的反应
B.自发反应一定是熵增加的反应,非自发反应一定是熵减小或不变的反应
C.熵增加且放热的反应一定是自发反应
D.非自发反应在任何条件下都不能发生
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3 Cl2+6 FeI2═2FeCl3+4 FeI3 | B. | Cl2+FeI2═FeCl2+I2 | ||
| C. | Co2O3+6 HCl═2CoCl2+Cl2↑+3H2O | D. | 2Fe3++2I-═2Fe2++I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | ||
| Z | W |
| A. | Y元素的气态氢化物易液化,是因为其分子间能形成氢键 | |
| B. | X元素最高价氧化物分子的比例模型为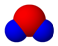 | |
| C. | Z单质与X元素最高价氧化物、Y单质都能反应,体现氧化性 | |
| D. | W的单质在地壳含量丰富,工业上可通过电解它的无水盐来制备 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cs显+3价,I、Cl均显-1价 | |
| B. | 在CsICl2溶液中通入SO2气体,有硫酸生成 | |
| C. | Cs显+1价,Cl显+1价,I显-3价 | |
| D. | 在CsICl2溶液中通入Cl2,有单质碘生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
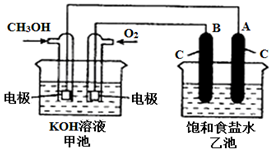 甲醇是一种可再生能源,具有广泛的开发和应用前景.如图是用甲醇燃料电池电解饱和食盐水的装置示意图.已知甲池的总反应式为:2CH3OH+3O2+4KOH═2K2CO3+6H2O.
甲醇是一种可再生能源,具有广泛的开发和应用前景.如图是用甲醇燃料电池电解饱和食盐水的装置示意图.已知甲池的总反应式为:2CH3OH+3O2+4KOH═2K2CO3+6H2O.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com