
在50 mL a mol·L-1的硝酸溶液中,加入6.4 g Cu,全部溶解,假设硝酸的还原产物只有NO2和NO,将反应后溶液用蒸馏水稀释至100 mL时测得c(NO3-)=3 mol·L-1。
(1)稀释后的溶液pH= ;
(2)若a=9,则生成的气体中NO2的物质的量为 mol。
(1)0 (2)0.125
解析试题分析:(1)因为铜全部溶解,因此溶液中铜离子的物质的量为0.1 mol,那么与铜离子相结合的硝酸根离子的物质的量为0.2 mol。又因为溶液中总的硝酸根离子的物质的量为0.3 mol,所以以硝酸形式存在的离子的物质的量为0.1 mol,也可以理解为溶液中剩余硝酸的物质的量为0.1 mol,那么硝酸的浓度为1mol·L-1,所以其pH=0。(2)若a=9,则题中所提供的硝酸总的物质的量为0.45 mol,减去剩余的0.3mol,那么被还原的硝酸的物质的量为0.15 mol。因为这是一个氧化还原反应,氧化剂所得到的电子与还原剂所失去的电子的物质的量相等,还原剂铜所失去的电子一定为0.2mol,假设反应中生成的二氧化氮的物质的量为x mol, 那么一氧化氮的物质的量就为:(0.15-x)mol,如是有如下关系:
0.2=(0.15-x)×3+x,解之得:x="0.125" mol
考点:考查电子守恒。


 导学全程练创优训练系列答案
导学全程练创优训练系列答案科目:高中化学 来源: 题型:填空题
I.根据反应3Cu+8HNO3 3Cu(NO3)2+2NO↑+4H2O,回答下列问题:
(1)氧化剂是 , 元素被氧化;
(2)用“双线桥”表示该反应电子转移的方向和数目:
3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O
(3)当有2 mol HNO3被还原时,被氧化的物质的质量为 ,转移的电子数为 ;
II. 有下列6种物质:K2SO4、K2SO3、I2、H2SO4、KIO3、H2O组成一个氧化还原反应,已知在反应中K2SO3失去电子。请将这6种物质组成一个化学方程式(需配平):
2002年9月26日,中国北京曙光公司研制出了第一款具有我国完全自主知识产权的高性能CPU 芯片— “龙芯”1号。该芯片中主要成分可以制成计算机长距离联网传输的线路材料,这种埋在地下的材 料如果裸露在碱性土壤中,结果会断路,用离子方程式说明原因
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
绿矾(FeSO4?7H2O)是中学阶段常用的一种还原剂。
(1)久置的绿矾溶液容易被空气氧化变质,简述检验绿矾溶液已经变质的操作和现象:取少量待测液于试管中, 。
(2)绿矾溶液浓度的标定测定溶液中Fe2+物质的量浓度的方法是:
a.量取25.00mL待测溶液于锥形瓶中;
b.用硫酸酸化的0.01000mol/L KMnO4溶液滴定至终点;
c.重复操作2次,消耗KMnO4溶液体积的体积分别为20.02mL、24.98mL、19.98mL。
(已知滴定时发生反应的离子方程式为5Fe2++MnO4—+8H+=5Fe3++Mn2++4H2O)
①判断此滴定实验达到终点的方法是 。
②计算上述滤液中Fe2+物质的量浓度 (保留四位有效数字)。
(3)探究保存绿矾溶液的有效措施
【反应原理】Fe2+在空气中易氧化变质,完成并配平下列离子方程式:
Fe2+ + O2 + = Fe(OH)3↓+ Fe3+
【操作与现象】取4支试管,如图进行实验,请在相应位置上写出试管①的现象和④的添加试剂。
【分析与结论】设计试管①的作用是 ;为了有效保存FeSO4溶液,你认为最佳方案为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
活性炭吸附法是工业提碘的主要方法之一。其流程如下: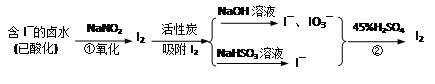
完成下列填空:
(1)酸性条件下,NaNO2溶液只能将 I-氧化为I2,同时生成NO。写出反应①的离子方程式并标出电子转移的数目和方向 。
(2)氯气、浓硝酸、酸性高锰酸钾等都是常用的强氧化剂,但工业上氧化卤水中I-选择了价格并不便宜的亚硝酸钠,可能的原因是什么? 。
(3)反应②发生时,溶液底部有紫黑色的固体生成,有时溶液上方产生紫色的气体。解释产生这种现象的原因 ,所以,反应②需要在 条件下进行。
(4)流程中,碘元素经过了I2→I-、IO3-→I2的变化过程,这样反复的原因是 。
(5)流程中用到的NaHSO3溶液显弱酸性。是因为该溶液中存在以下的平衡:
①HSO3– + H2O H2SO3 + OH– 和 ② (写出离子方程式)
H2SO3 + OH– 和 ② (写出离子方程式)
向0.1mol/L的NaHSO3溶液中分别加入以下物质,回答问题:
a.加入少量金属Na,平衡①如何移动? 溶液的pH如何变化?
b.加入氨水至中性,则式子:c(Na+) = c(SO32–)+ c(HSO3–)+ c(H2SO3)>c(H+) = c(OH–),是否正确 ,解释原因 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
氢化钠(NaH)是一种还原性极强的物质,广泛应用于工业生产。
(1)氢化钠(NaH)中氢元素的化合价为 。
(2)NaH能与水剧烈反应:NaH+H2O= NaOH+H2↑,该反应中的氧化剂是 。如果有12gNaH与水反应,则转移电子的个数为 。
(3)在高温下氢化钠(NaH)可将四氯化钛(TiC14)还原成金属钛,该反应的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
氮元素十分重要,其单质及其化合物在科研、生产领域有着十分广泛的用途。
(1)氮元素核外电子排布式为: ,原子核外共有 种不同能级的电子,氮原子核外电子云有 种不同的伸展方向,有 种不同运动状态的电子。
(2)最新“人工固氮”的研究报道:常温常压、光照条件下,N2在催化剂表面与水发生反应:
2N2 (g)+6H2O (l) 4NH3 (g)+3O2 (g) - Q ,如果反应的平衡常数K值变大,该反应 (选填编号)。
4NH3 (g)+3O2 (g) - Q ,如果反应的平衡常数K值变大,该反应 (选填编号)。
A.一定向正反应方向移动
B.在平衡移动时正反应速率先增大后减小
C.一定向逆反应方向移动
D.在平衡移动时逆反应速率先减小后增大
(3)如果上述反应在体积不变的密闭容器中进行,当反应达到平衡后,下列判断错误的是
A.容器中气体的平均分子量不随时间而变化 B.通入大量稀有气体能提高反应的速率
C.容器中气体的密度不随时间而变化 D.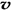 (N2)/
(N2)/ 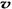 (O2)=2:3
(O2)=2:3
(4)高氯酸铵作为火箭燃料的重要氧载体。高氯酸铵在高压、450℃的条件下迅速分解,反应的化学方程式4NH4ClO4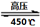 6H2O↑+ 2N2↑+ 4HCl↑+ 5O2↑,其中氧化产物与还原产物的物质的量之比是 ,每分解1mol高氯酸铵,转移的电子数目是 。
6H2O↑+ 2N2↑+ 4HCl↑+ 5O2↑,其中氧化产物与还原产物的物质的量之比是 ,每分解1mol高氯酸铵,转移的电子数目是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
黄铜矿(CuFeS2)是制取铜及其化合物的主要原料之一,还可制备硫及铁的化合物。
(1)冶炼铜的反应为: 8CuFeS2+21O2 8Cu+4FeO+2Fe2O3+16SO2
8Cu+4FeO+2Fe2O3+16SO2
若CuFeS2中Fe的化合价为+2,反应中被还原的元素是 (填元素符号)。
(2)利用黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3)可制备Fe2O3。方法为:
①用稀盐酸浸取炉渣,过滤。
②滤液先氧化,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得Fe2O3。
除去Al3+的离子方程式是 。
(3)为验证炉渣中含有FeO,先将炉渣用稀酸溶解,再在酸性条件下加入适当的氧化剂。(提供的试剂:稀盐酸、稀硫酸、KSCN溶液、酸性KMnO4溶液、NaOH溶液、碘水)
所选试剂为 、 ,证明炉渣中含有FeO的实验现象为 。
(4)配平上述反应的离子方程式(氧化性物质依据你的选择填入[ ])
Fe2++ H++ [ ] → Fe3++ [ ]+ H2O
(5)如果证明炉渣中是否含有FeO,将炉渣溶于稀硝酸,每含有1molFeO,可产生气体的体积是 L(标准状况,假设硝酸的还原产物只有NO)。
(6)Fe2O3可以作为染料,也可进一步制得净水剂Fe2(SO4)3, Fe2(SO4)3的净水原理是 (用相应的方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)在下列反应中:
| A.2F2+2H2O=4HF+O2↑; | B.2Na+2H2O=2NaOH +H2↑; | C.CaO+H2O=Ca(OH)2; | D.2H2O 2H2↑+O2↑。其中(填序号): 2H2↑+O2↑。其中(填序号): |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
实验室中所用少量氯气是用下列方法制取的:
4HCl(浓)+MnO2 Cl2↑+MnCl2+2H2O
Cl2↑+MnCl2+2H2O
(1)该反应既是离子反应也是氧化还原反应。该反应的还原剂是 (用化学式表示)。
氯气有毒会污染空气,实验室常用氢氧化钠吸收该实验的尾气,写出用氢氧化钠溶液吸收氯气的离子方程式 。
(2)若有17.4gMnO2与足量的浓盐酸充分反应后, 所得溶液的体积为500 mL,求:
①转移电子数为______ _;
②被氧化的HCl的物质的量_______ mol;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com