
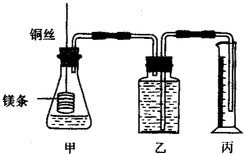
 某研究性学习小组为证明在同温同压下,相同浓度相同体积的不同强度的一元酸与足量镁带反应时,生成氢气的体积相同而反应速率不同,同时测定实验室条件下的气体摩尔体积.设计的简易实验装置如图,该实验的主要操作步骤如下:
某研究性学习小组为证明在同温同压下,相同浓度相同体积的不同强度的一元酸与足量镁带反应时,生成氢气的体积相同而反应速率不同,同时测定实验室条件下的气体摩尔体积.设计的简易实验装置如图,该实验的主要操作步骤如下:分析 ①根据酸式滴定管和碱式滴定管的使用要求来选择;
③目的是要将盐酸完全反应,根据镁与盐酸反应的关系式确定镁的质量;
⑤比较化学反应速率,必须是比较一定时间之内的反应物浓度的变化或其它量的变化;
⑥读数时要保持左右气体压强相等,以减少误差进行分析;
(1)由图可知用热捂法检查气密性;
(2)根据反应的化学方程式计算生成标况下氢气的体积,然后判断量筒规格;
(3)根据气体摩尔体积Vm=$\frac{V}{n}$进行计算;
(4)从影响化学反应速率的因素之浓度来分析;根据镁与铜易形成原电池,加快反应速率,干扰实验测定.
解答 解:①酸式滴定管装酸性溶液,如用碱式滴定管会腐蚀橡胶管,故答案为:酸式滴定管;
③目的是要将盐酸完全反应,镁与盐酸反应的关系式为:Mg~2HCl,盐酸的用量是10.00mL 1mol•L-1,所以n(HCl)=0.0100mol,则镁至少用0.0050mol,其质量为:m(Mg)=n(Mg)•M(Mg)=0.0050mol×24g•mol-1=0.1200g,精确的天平可以达到这个要求,
故答案为:0.1200;
⑤比较化学反应速率,必须是比较一定时间之内的反应物浓度的变化或其它量的变化,
故答案为:反应所需时间;
⑥读数时要保持左右气体压强相等,以减少误差,所以反应结束后待温度恢复到室温,若丙中液面高于乙中液面,读取量筒中水的体积前,应将丙向下移动,使乙、丙中液面相平,再读数,
故答案为:将丙向下移动,使乙、丙中液面相平;
(1)由图可知用热捂法检查气密性,用手捂住锥形瓶,量筒中有液体流出,松手后,量筒的液体回流,证明气密性良好,
故答案为:用手捂住锥形瓶,量筒中有液体流出,松手后,量筒的液体回流,证明气密性良好;
(2)根据反应的化学方程式计算生成标况下氢气的体积,Mg+2HCl═MgCl2+H2↑,2HCl~H2,n(HCl)=0.0100mol,所以n(H2)=0.0050mol,标况下氢气的体积为:V(H2)=0.005 mol×22.4L/mol=0.112L=112ml,而实验是在室温下进行,温度高于标况的0℃,压强是相同的,那么氢气的体积会比112ml大一些,所以应选200 mL量筒,
故答案为:B;
(3)收集到的氢气体积为VmL,这部分氢气的物质的量由前面分析得出n(H2)=0.0050mol,再根据气体摩尔体积Vm=$\frac{V}{n}$,代入数据Vm=$\frac{V×1{0}^{-3}L}{0.0050mol}$=$\frac{V}{5}$ L•mol-1,
故答案为:$\frac{V}{5}$ L•mol-1;
(4)两种酸的物质的量浓度相等,但盐酸是强酸,完全电离,醋酸是弱酸,部分电离,所以氢离子物质的量浓度是前者大于后者,金属与酸反应的实质是与氢离子的反应,氢离子浓度越大,反应速率越快;镁与铜易形成原电池,会加快反应速率,干扰实验测定,所以铜丝不与酸接触,
故答案为:两种酸的物质的量浓度相等,但盐酸是强酸完全电离,醋酸是弱酸部分电离,氢离子物质的量浓度前者大于后者;防止形成原电池,影响反应速率.
点评 本题考查了探究影响化学反应速率的因素的方法,涉及了配制一定浓度的溶液的仪器选用、化学基本实验操作等知识,题目难度中等,注意掌握影响化学反应速率的因素.


 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案科目:高中化学 来源: 题型:选择题
| 选项 | 混合物 | X | Y |
| ① | C3H6、C2H4 | m | 15m/7 |
| ② | HCHO、HCOOH | m | 15m/23 |
| ③ | CH3OH、CH3COOH | m | m |
| ④ | HCOOH、CH3COOCH3 | m | m |
| A. | ①② | B. | ③② | C. | ①③ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
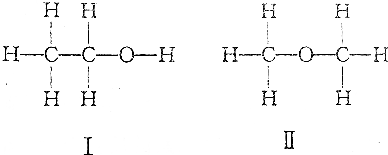
| A. | Ⅰ和Ⅱ是同分异构体 | B. | Ⅰ和Ⅱ物理性质有所不同 | ||
| C. | Ⅰ和Ⅱ化学性质相同 | D. | Ⅰ和Ⅱ含12C的质量分数相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
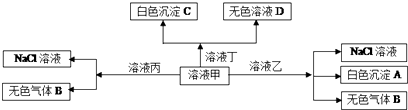
| A. | 甲为AlCl3,乙为NaHCO3 | |
| B. | 在甲中滴加丁开始反应的离子方程式:2HCO3-+Ba2++2OH-B═aCO3↓+2H2O+CO32- | |
| C. | 白色沉淀A不能溶解在溶液丁中 | |
| D. | 在丙中可以大量共存的有:Fe2+、SO42-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 离子 | K+ | Na+ | NH${\;}_{4}^{+}$ | SO${\;}_{4}^{2-}$ | NO3 | Cl- |
| 浓度/mol•L-l | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
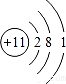 ,其中三种主族元素的离子半径从大到小的顺序是N3->O2->Na+ (用离子符号表示)
,其中三种主族元素的离子半径从大到小的顺序是N3->O2->Na+ (用离子符号表示)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com