
| ||
 ;2H2O2
;2H2O2
| ||
 ,
, ;
;

科目:高中化学 来源: 题型:
| A、①② | B、①③ | C、②④ | D、③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、1mol H2和0.5mol O2所具有的总能量低于1mol气态H2O所具有的总能量 | ||
| B、氢气跟氧气反应生成水的同时吸收能量 | ||
C、1mol H2跟
| ||
| D、2mol H2(g)跟1mol O2(g)反应生成2mol H2O(g)释放能量490kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 3 |
| 5 |
| 离子 | Cu2+ | H+ | CI- | SO42- |
| c/mol?L-1 | 0.5 | 2 | 2 | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度/K | 反应I | 反应Ⅱ | 已知: K1>K2>K1′>K2′ |
| 298 | K1 | K2 | |
| 328 | K1′ | K2′ |

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | K2CO3 | KHCO3 | K2SO3 |
| 质量(kg) | 55.2 | 120.0 | 63.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、合成聚乙烯塑料: | |||
B、溴乙烷与氢氧化钠溶液共热:CH3CH2Br+NaOH
| |||
C、向稀苯酚溶液中滴加少量浓溴水:2 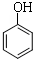 +3Br2→2 +3Br2→2 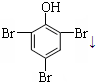 ↓ ↓ | |||
D、实验室制乙烯:CH3CH2OH
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com