
| A. | c(Na+)>c(CH3COO-)的CH3COOH与CH3COONa的混合溶液 | |
| B. | 常温下,pH=3的CH3COOH与pH=11的NaOH溶液等体积混合 | |
| C. | 含OH-的溶液 | |
| D. | 滴加甲基橙后溶液显红色 |
分析 只要电解质溶液中存在c(OH-)>c(H+),则该溶液一定呈碱性,根据选项溶液中c(OH-)、c(H+)相对大小判断溶液酸碱性,据此分析解答.
解答 解:只要电解质溶液中存在c(OH-)>c(H+),则该溶液一定呈碱性,
A.c(Na+)>c(CH3COO-)的CH3COOH与CH3COONa的混合溶液中存在电荷守恒c(Na+)+c(H+)=c(CH3COO-)+c(OH-),则c(OH-)>c(H+),该溶液呈碱性,故A正确;
B.常温下,pH=3的CH3COOH浓度大于pH=11的NaOH溶液浓度,二者等体积混合时,醋酸有剩余,醋酸电离程度大于溶液中醋酸根离子水解程度导致溶液呈酸性,故B错误;
C.任何电解质水溶液中都含有OH-,不能根据含有OH-来判断溶液酸碱性,故C错误;
D.甲基橙变色范围是3.1-4.4,所以甲基橙显红色的溶液呈酸性,故D错误;
故选A.
点评 本题考查溶液酸碱性判断,为高频考点,溶液酸碱性要根据溶液中c(OH-)、c(H+)相对大小判断,不能根据溶液中c(OH-)或c(H+)、溶液pH(温度未知时)、指示剂变色范围等判断,易错选项是C.


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案科目:高中化学 来源: 题型:解答题


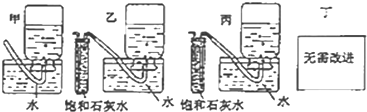
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用大量SO2漂白银耳 | |
| B. | 用小苏打(NaHCO3)焙制糕点 | |
| C. | 用食醋清洗热水瓶胆内壁附着的水垢(CaCO3) | |
| D. | 用消毒液(有效成分NaClO)对餐具进行杀菌消毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
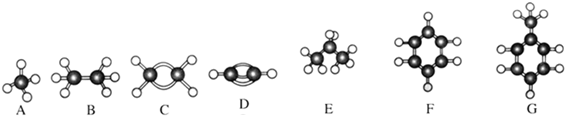
| 试剂 | |
| 乙烷混有少量乙烯 | |
| 溴苯混有少量溴单质 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 互为同位素的两种原子 | B. | 两种不同元素的原子 | ||
| C. | 一种原子和一种离子 | D. | 一种阴离子和一种阳离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com