
| A.2.25mol/L | B.2mol/L | C.0.3mol/L | D.0.6mol/L |
 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案科目:高中化学 来源:不详 题型:填空题
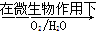 Fe2++SO42-
Fe2++SO42-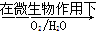 Fe3+
Fe3+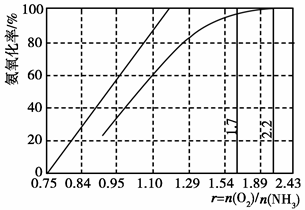
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.用FeCl3溶液腐蚀铜制印刷电路板:Fe3++Cu=Fe2++Cu2+ |
| B.NH4HCO3溶液和过量的NaOH溶液相混合:HCO3—+OH-=CO32—+H2O |
| C.向Fe2(SO4)3的酸性溶液中通入足量H2S:Fe3++H2S=FeS↓+2H+ |
| D.FeI2溶液中通入Cl2至I-恰好完全被氧化:2I-+Cl2=I2+2Cl- |
查看答案和解析>>
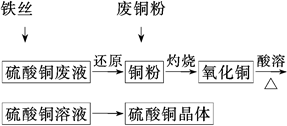
科目:高中化学 来源:不详 题型:填空题
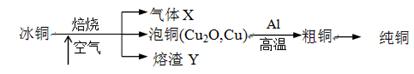
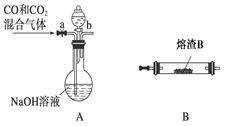

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
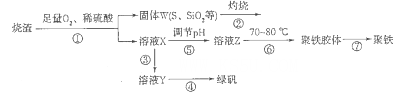
 2K2S+K2SO3+3H2O,该反应的氧化剂与还原剂质量之比为___________。
2K2S+K2SO3+3H2O,该反应的氧化剂与还原剂质量之比为___________。查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| 实验步骤 | 预期现象与结论 |
| 步骤1:取2mLFeSO4溶液和2mLKI溶液混合于试管中,再滴加1~2滴氯水。 | ; |
| 步骤2:____________________________________ ____________________________________。 | |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com