
| A. | 需要加热方能发生的反应一定是吸热反应 | |
| B. | 放热的反应在常温下一定很容易发生 | |
| C. | 反应是放热还是吸热必须看反应物和生成物所具有总能量的相对大小 | |
| D. | 吸热反应在一定的条件下也能发生 |
分析 吸热反应与放热反应与是否加热无关,化学反应中,反应物的总能量大于生成物的总能量,反应放热,反之吸热,以此解答该题.
解答 解:A.需要加热方能发生的反应不一定为吸热反应,如铝热反应,故A错误;
B.铝热反应为放热,但常温下不反应,故B错误;
C.化学反应的能量变化主要表现为放热或吸热,反应是放热还是吸热主要取决于反应物和生成物所具有的总能量的相对大小,反应物的总能量大于生成物的总能量,则反应放热,反之吸热,故C正确;
D.一些吸热反应可在加热条件下进行,有些在常温下进行,如氯化铵和氢氧化钡晶体的反应,故D正确.
故选AB.
点评 本题考查了化学反应过程中的能量变化知识,为高频考点,侧重于双基的考查,注意常见的吸热以及放热反应是解题的关键,注意把握反应的热效应与反应条件的关系,难度不大.


科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳和水反应吸收131.3kJ 能量 | |
| B. | 1mol 碳和1mol 水反应生成一氧化碳和氢气并吸收131.3kJ 热量 | |
| C. | 1mol 固态碳和1mol 水蒸气反应生成一氧化碳气体和氢气,并吸热131.3kJ | |
| D. | 1 个固态碳原子和1 分子水蒸气反应吸热131.1kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,6.72L NO2与水充分反应转移的电子数目为0.2NA | |
| B. | 1mo1的Fe在1mo1Cl2中充分燃烧,转移电子数为3NA | |
| C. | 7.2g CaO2中的阴离子含有的电子数为1.0NA | |
| D. | 标准状况下,22.4L盐酸含有2NA个离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:99 | B. | 1:100 | C. | 100:1 | D. | 99:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
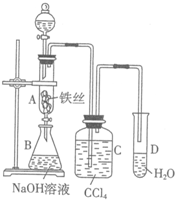 某化学课外小组用图装置制取溴苯.
某化学课外小组用图装置制取溴苯. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com