
| A. |  玻璃棒 | B. |  酒精灯 | C. |  胶头滴管 | D. |  容量瓶 |
分析 配制250mL 0.5mo1•L-1NaCl的步骤为:计算、量取、稀释、冷却、移液、洗涤移液、定容、摇匀等操作,根据操作步骤判断使用的仪器,如:配制过程中不需要加热,则不会用到酒精灯.
解答 解:配制250mL 0.5mo1•L-1NaCl溶液的步骤有:计算、量取、稀释、冷却、移液、洗涤移液、定容、摇匀等操作;一般用量筒量取(用到胶头滴管),在烧杯中稀释,并用玻璃棒搅拌,冷却后转移到250mL容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,滴加至溶液凹面与刻度线水平相切,盖好瓶塞,摇匀;
所以需要的仪器为:量筒、烧杯、玻璃棒、250mL容量瓶、胶头滴管,
配制过程不需要加热,所以不需要的仪器是酒精灯,
故选B.
点评 本题考查了溶液配制过程中仪器的选择方法,题目难度不大,熟练掌握配制一定物质的量浓度的溶液步骤是解题的关键,注意掌握常见仪器的构造及使用方法,试题培养了学生的化学实验能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
 在恒容密闭容器中加入一定量的反应物后存在下列平衡:CO(g)+H2O(g)?CO2(g)+H2(g),平衡时CO2物质的量浓度与温度的关系如图所示,下列说法错误的是( )
在恒容密闭容器中加入一定量的反应物后存在下列平衡:CO(g)+H2O(g)?CO2(g)+H2(g),平衡时CO2物质的量浓度与温度的关系如图所示,下列说法错误的是( )| A. | 反应CO(g)+H2O(g)?CO2(g)+H2(g)的△H>0 | |
| B. | 在T2时,D点的反应速率:ν(逆)>ν(正) | |
| C. | 平衡状态A与C相比,平衡状态A的c(CO)小 | |
| D. | 若T1、T2时的平衡常数分别为K1、K2,则K1<K2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+Na+Br-S2- | B. | Al3+Ca2+NO3-Cl- | ||
| C. | Na+K+AlO2- NO3- | D. | K+Na+SO42-S2O32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | ||
| Y | ||
| Z |
| A. | Z与铁反应生成的化合物中铁元素显正三价 | |
| B. | X的最高价氧化物的水化物是一种强酸 | |
| C. | 1 mol单质Y跟足量水反应时,转移1 mol电子 | |
| D. | Z有ZO2、ZO3两种氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | pH=2的HA溶液与pH=12的MOH溶液以任意比混合:c(H+)+c(M+)═c(OH-)+c(A-) | |
| B. | NH4Cl溶液中:c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| C. | 常温下,将醋酸钠、盐酸两溶液混合呈中性的溶液中:c(Na+)>c(Cl-)=c(CH3COOH) | |
| D. | 常温下,等物质的量浓度的三种溶液①(NH4)2CO3②(NH4)2SO4③(NH4)2Fe(SO4)2)中c(NH4+):①<③<② |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ag某气体的分子数为b,则cg该气体在标况下的体积为$\frac{22.4bc}{a{N}_{A}}$L | |
| B. | 2L0.5mol.L-1磷酸溶液中含有H+的数目为3NA | |
| C. | 25℃,PH=13的Ba(OH)2溶液中含有OH-为0.1NA | |
| D. | 标准状况下,28g乙烯和丙烯的混合气体中,含有碳碳双键的数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通过溴水除去甲烷中的乙炔 | |
| B. | 将乙醇加热到170℃制备乙烯 | |
| C. | 加入浓溴水后过滤除去苯中的苯酚 | |
| D. | 加入氢氧化钠后蒸馏除去乙酸乙酯中的乙酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 五种元素的原子半径从大到小的顺序是:Z>W>M>Y>X | |
| B. | 氢化物的还原性:Y>M>W | |
| C. | Y和M的氧化物都是酸性氧化物 | |
| D. | X2Z的电子式为: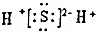 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
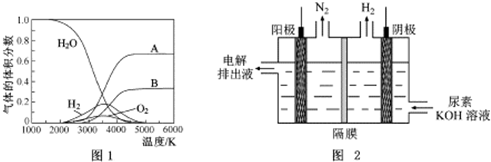
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com