
体积分数/% 压强/MPa 温度/℃ | 1.0 | 2.0 | 3.0 |
| 810 | 54.0 | a | b |
| 915 | c | 75.0 | d |
| 1 000 | e | f | 83.0 |
| A. | a<54.0 | B. | b>f | ||
| C. | 915℃,2.0 MPa时E的转化率为60% | D. | K(1000℃)>K(810℃) |
分析 A、同温下,增大压强,平衡逆向进行,平衡时G的体积分数变小,故可知c>75.0>54.0>a>b;
B、同温下,增大压强,平衡逆向进行,平衡时G的体积分数变小,故可知c>75.0>54.0>a>b,利用c>75.0>54.0可知同压下,升温平衡正向移动,即正反应为吸热反应,从而可知f>75.0;
C、在915℃、2M Pa下,设E的起始量为amol,转化率为x,则平衡时G的量为2ax,由题意得$\frac{2ax}{a-ax+2ax}$×100%=75%,解得x=0.6;
D、结合前面分析知升温平衡正向移动,则平衡常数增大.
解答 解:A、同温下,增大压强,平衡逆向进行,平衡时G的体积分数变小,故可知c>75.0>54.0>a>b,所以54.0>a,故A正确;
B、利用图表分析结合平衡原理分析;a与b、c与d、e与f之间是压强问题,随着压强增大,平衡逆向移动,G的体积分数减小,b<a;c>75%,e>83%,f的温度比b的高,压强比b的小,所以f>b,故B错误;
C、设E的起始量为amol,转化率为x,则平衡时G的量为2ax,由题意得$\frac{2ax}{a-ax+2ax}$×100%=75%,解得x=0.6,α=60%,故C正确;
D、e是温度问题,随着温度升高,G的体积分数增大,所以正反应是一个吸热反应,所以,K(1000℃)>K(810℃),故D正确;
故选B.
点评 本题考查化学平衡影响因素分析,数据处理的方法应用,平衡计算和对比判断是解题关键,题目难度中等.


 寒假学与练系列答案
寒假学与练系列答案科目:高中化学 来源: 题型:选择题
| A. | Cu+2AgNO3═Cu(NO3)2+2Ag | B. | 2Fe+O2+2H2O═2Fe(OH)2 | ||
| C. | NaOH+HCl═NaCl+H2O | D. | 2H2+O2═2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 CH2=CHCOOCH2CH3+H2O,该反应的类型是取代反应;
CH2=CHCOOCH2CH3+H2O,该反应的类型是取代反应; ;
;
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 外围电子分别是1s2与2s2的元素 | |
| B. | M层上有两个电子与N层上有两个电子的元素 | |
| C. | 2p上有一个未成对电子与3p上有一个未成对电子的元素 | |
| D. | L层上有一个空轨道和M层的p轨道上有一个空轨道的元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子晶体中一定含有离子键 | |
| B. | 分子晶体中一定含有共价键 | |
| C. | 氧化钠和过氧化钠中含有的化学键种类相同 | |
| D. | 通常情况下水分子较稳定,是因为水分子间存在氢键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向铁粉中加入足量稀硝酸:2Fe+6H+═2Fe3++3H2↑ | |
| B. | NO2溶于水:3NO2+H2O═2H++2NO3-+NO | |
| C. | 氢氧化铜与稀硝酸反应:H++OH-═H2O | |
| D. | 向AlCl3溶液中滴加浓氨水至过量:Al3++4OH-═AlO2-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

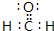 ,推测该分子的空间构型为平面三角形.
,推测该分子的空间构型为平面三角形.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com