
����Ŀ�����Ļ������ڹ�ҵ������Ҫ��Ӧ�ã�
��1��FeCl3��ˮ��ԭ���ǣ������ӷ���ʽ��ʾ��_________________��FeCl3��Һ��ʴ�����豸����H+�����⣬��һ��Ҫԭ���ǣ������ӷ���ʽ��ʾ��________________��
��2��Ϊ��Լ�ɱ�����ҵ����NaClO3 ��������FeCl2��Һ�õ�FeCl3��
��������FeCl2��Һ��c��Fe2+��=2.0��10��2molL��1��c��Fe3+��=1.0��10��3molL��1��c��Cl����=5.3��10��2molL��1�������Һ��PHԼΪ_____��
�����NaClO3 ����FeCl2 �����ӷ���ʽ��
��ClO3�� +___Fe2+ +___ ____= __Cl�� + ___Fe3++ __ ____��
��3��������أ�K2FeO4����һ�����͡���Ч�����ˮ���������Ҳ�����ɶ�����Ⱦ����֪�����������ȶ��Բ��ҵ����ʪ���Ʊ�K2FeO4��������ͼ1��ʾ����Ӧ�ۼ���ŨKOH��Һ������������أ�K2FeO4������˵��__________________________��ij�¶��£���Cl2ͨ��NaOH��Һ�У���Ӧ��õ�NaCl��NaClO��NaClO3�Ļ����Һ�����ⶨClO����ClO3�����ӵ����ʵ���֮����1��2����Cl2���������Ʒ�Ӧʱ������ԭ����Ԫ�غͱ���������Ԫ�ص����ʵ���֮��Ϊ_____��
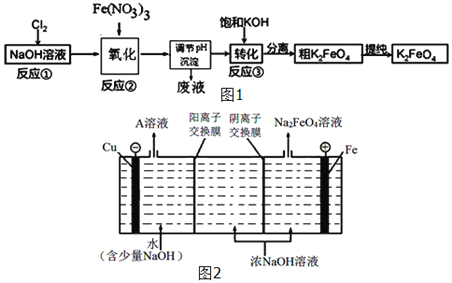
��4����ҵ�ϻ�����ͨ�����ŨNaOH��Һ���Ʊ�Na2FeO4���乤��ԭ����ͼ2��ʾ�������ĵ缫��ӦʽΪ__________________________��
���𰸡� Fe3++3H2O![]() Fe��OH��3��������+3H+ 2Fe3++Fe=3Fe2+ 2 1 6 6H+ 1 6 3 H2O ���¶��£�������ص��ܽ�ȱȸ������Ƶ��ܽ��С 11��3 Fe+8OH����6e��=FeO42��+4H2O
Fe��OH��3��������+3H+ 2Fe3++Fe=3Fe2+ 2 1 6 6H+ 1 6 3 H2O ���¶��£�������ص��ܽ�ȱȸ������Ƶ��ܽ��С 11��3 Fe+8OH����6e��=FeO42��+4H2O
����������1��FeCl3��ˮ��ԭ����FeCl3ˮ������Fe(OH)3���壬����ˮ�����������ʣ������ӷ���ʽ��ʾ��Fe3++3H2O![]() Fe��OH��3�����壩+3H+ ��Fe3����������ǿ������Fe����2Fe3++Fe=3Fe2+ ����2����������FeCl2��Һ��c��Fe2+��=2.0��10��2molL��1��c��Fe3+��=1.0��10��3molL��1��c��Cl����=5.3��10��2molL��1�����ݵ���غ㣬c(H��)+2c��Fe2+��+3c��Fe3+��=c��Cl����+c��OH������c(H��)=5.3��10��2molL��1-��2��2.0��10��2molL��1+3��1.0��10��3molL��1��=1.0��10��2molL��1��PH=-lg1.0��10��2=2�������Һ��PHԼΪ2����ClO3����ClԪ�ػ��ϼ���+5�۽���ΪCl-��-1�ۣ�Fe2+����Ԫ����+2������Ϊ+3�ۣ�Fe2+�ǻ�ԭ�������ϼ���������С������Ϊ6������Fe2+ϵ��Ϊ6��ClO3��ϵ��Ϊ1������ԭ���غ��֪��Fe3+ϵ��Ϊ6��Cl��ϵ��Ϊ1��H2Oϵ��Ϊ3��Ȼ��ͨ������غ㣬�������ӣ���ƽ�����ӷ���ʽΪ��1ClO3�� +6Fe2+ +6 H+= 1Cl�� + 6Fe3++ 3 H2O����3������ŨKOH��Һ������������أ�K2FeO4����˵�����¶��£�������ص��ܽ�ȱȸ������Ƶ��ܽ��С��Cl2����ClO����ClO3���DZ������Ĺ��̣����ϼ۷ֱ���0������Ϊ+1�ۺ�+5�ۣ����ⶨClO����ClO3�����ʵ���֮��Ϊ1��2�������ClO��Ϊ1mol��ClO3��Ϊ2mol������������Ԫ�ص����ʵ���Ϊ��1mol+2mol=3mol�����ݻ��ϼ۱仯��֪����Ӧ��ʧȥ���ӵ������ʵ���Ϊ��1mol����1-0��+2mol����5-0��=11mol��������ԭ��Ӧ�е�ʧ������Ŀһ����ȣ���÷�Ӧ��ʧȥ���ӵ����ʵ���Ҳ��11mol��Cl2����KCl�DZ���ԭ�Ĺ��̣����ϼ���0�۽���Ϊ-1�ۣ���ԭ��Cl�����ʵ���Ϊ��
Fe��OH��3�����壩+3H+ ��Fe3����������ǿ������Fe����2Fe3++Fe=3Fe2+ ����2����������FeCl2��Һ��c��Fe2+��=2.0��10��2molL��1��c��Fe3+��=1.0��10��3molL��1��c��Cl����=5.3��10��2molL��1�����ݵ���غ㣬c(H��)+2c��Fe2+��+3c��Fe3+��=c��Cl����+c��OH������c(H��)=5.3��10��2molL��1-��2��2.0��10��2molL��1+3��1.0��10��3molL��1��=1.0��10��2molL��1��PH=-lg1.0��10��2=2�������Һ��PHԼΪ2����ClO3����ClԪ�ػ��ϼ���+5�۽���ΪCl-��-1�ۣ�Fe2+����Ԫ����+2������Ϊ+3�ۣ�Fe2+�ǻ�ԭ�������ϼ���������С������Ϊ6������Fe2+ϵ��Ϊ6��ClO3��ϵ��Ϊ1������ԭ���غ��֪��Fe3+ϵ��Ϊ6��Cl��ϵ��Ϊ1��H2Oϵ��Ϊ3��Ȼ��ͨ������غ㣬�������ӣ���ƽ�����ӷ���ʽΪ��1ClO3�� +6Fe2+ +6 H+= 1Cl�� + 6Fe3++ 3 H2O����3������ŨKOH��Һ������������أ�K2FeO4����˵�����¶��£�������ص��ܽ�ȱȸ������Ƶ��ܽ��С��Cl2����ClO����ClO3���DZ������Ĺ��̣����ϼ۷ֱ���0������Ϊ+1�ۺ�+5�ۣ����ⶨClO����ClO3�����ʵ���֮��Ϊ1��2�������ClO��Ϊ1mol��ClO3��Ϊ2mol������������Ԫ�ص����ʵ���Ϊ��1mol+2mol=3mol�����ݻ��ϼ۱仯��֪����Ӧ��ʧȥ���ӵ������ʵ���Ϊ��1mol����1-0��+2mol����5-0��=11mol��������ԭ��Ӧ�е�ʧ������Ŀһ����ȣ���÷�Ӧ��ʧȥ���ӵ����ʵ���Ҳ��11mol��Cl2����KCl�DZ���ԭ�Ĺ��̣����ϼ���0�۽���Ϊ-1�ۣ���ԭ��Cl�����ʵ���Ϊ��![]() =11mol�����Ա���ԭ����Ԫ�غͱ���������Ԫ�ص����ʵ���֮��Ϊ11mol��3mol=11��3����4�����������������������ŵ�����FeO42���������Ǽ��Ի������ʵ缫����ʽΪ��Fe+8OH��-6e��=FeO42��+4H2O��
=11mol�����Ա���ԭ����Ԫ�غͱ���������Ԫ�ص����ʵ���֮��Ϊ11mol��3mol=11��3����4�����������������������ŵ�����FeO42���������Ǽ��Ի������ʵ缫����ʽΪ��Fe+8OH��-6e��=FeO42��+4H2O��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������һ����Ҫ�Ľ�����
(1)����Ԫ�����ڱ��е�λ����_______________________________��
(2)�������������ȷ�Ӧ���Ӹֹ죬����������������Ӧ�Ļ�ѧ����ʽΪ____________�����ȷ�ӦҲ�������ڽ�����ұ������ͬѧ��Ϊ������þ�����ַ�һ���ڸ����¿�����þ��ұ��������Ϊ��˵��________����Իԣ�����Ϊ���Ե���˵��ԭ��____________________________��д��þ��ұ���Ļ�ѧ����ʽ ________________________________________����Ϊ�ԵĴ���ɲ�������
(3)����NaOH��Һ��Ӧ�����ӷ���ʽΪ_____________________��
(4)��AlCl3��ҺΪԭ����ȡ��ˮAlCl3�����Ƶ�AlCl3��6H2O���壬��Ҫ����������________������ȴ�ᾧ���۹��ˡ��ڵڢٲ�������Ӧע���������__________________��
(5).����AlCl3��6H2O���壬�ܽ�һ����ȡ��ˮAlCl3���˲���Ӧע����___________ ����ԭ����(��ϻ�ѧ����ʽ��Ҫ˵��)______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и����е����ӣ�������Һ�д����������
A. H�� Na�� CO32�� Cl�� B. Ba2�� Na�� Cl�� SO42��
C. K�� H�� SO42�� OH�� D. Ag�� Al3�� NO3�� H��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ϩ�棨CH2=CHCN����һ����Ҫ�Ļ���ԭ�ϣ���ҵ�Ͽ�������ϩ������������������Ҫ�������б�ϩȩ��CH2=CHCHO��������CH3CN �ȣ��ش��������⣺
��1���Ա�ϩ����������Ϊԭ�ϣ��ڴ������������ɱ�ϩ����C3H3N���������ϩȩ��CH2=CHCHO�����Ȼ�ѧ����ʽ���£�
�� C3H6(g)+NH3(g)��O2(g)=C3H3N(g)+3H2O(g����H=-515kJ/mol
�� C3H6(g)+O2(g)=C3H4O(g)��H2O(g) ��H=-353kJ/mol
��������߱�ϩ��ƽ����ʵķ�Ӧ������______����߱�ϩ�淴Ӧѡ���ԵĹؼ�������_____.
��2��ͼ��a��Ϊ��ϩ������뷴Ӧ�¶ȵĹ�ϵ���ߣ���߲��ʶ�Ӧ�¶�Ϊ460��������460��ʱ����ϩ��IJ���________��������������������������Ӧ�¶��µ�ƽ����ʣ��ж�������_____������460��ʱ����ϩ����ʽ��͵Ŀ���ԭ����________��˫ѡ�����ţ���
A���������Խ��� B.ƽ�ⳣ����� C������Ӧ���� D. ��Ӧ�������

��3����ϩ��ͱ�ϩȩ�IJ�����n������/n����ϩ���Ĺ�ϵ��ͼ��b����ʾ����ͼ��֪�����n������/n����ϩ��ԼΪ_________ ��������_______�����ϰ�����������ϩ���������ԼΪ____________��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ǰ������Ԫ��A��B��C��D��E��F��ԭ��������������A�������к�����ḻ��Ԫ�أ�B��Cͬһ���壬��B��L���������K���������2.5����D��Cͬһ���ڣ�EԪ��ԭ�Ӻ��������17�ֲ�ͬ���˶�״̬��Fλ�ڵ������ڣ���δ�ɶԵ�����ֻ��һ�������ڲ㶼����ȫ����״̬����ش��������⣺
��1��Bԭ�ӵ�L������Ų�ͼ____________��
��2����A��Bԭ���γɵķ��ӵĽṹʽΪ��A-B=B-A����÷�������������������Ŀ֮��Ϊ________��B��C���⻯����BH3�ķе���� CH3�ķе㣬ԭ����___________��C��D��E�ĵ縺���ɴ�С��˳��Ϊ___________��C��D��E�ĵ�һ�������ɴ�С��˳����____________��C��D��ۺ����������������ǿ��˳��Ϊ_________________��CO![]() ��C���ӻ���ʽΪ___________�������ӵ���VSEPR��ģ��Ϊ__________________�Ρ�
��C���ӻ���ʽΪ___________�������ӵ���VSEPR��ģ��Ϊ__________________�Ρ�
��3����FDO4��Һ�м������ϡ��ˮ���õ�������ɫ��Һ�������ӻ�ѧʽΪ_______�������ӵ���λ��Ϊ________________��
��4��D������F�������γɵ�ij�־���ľ�������ͼ��ʾ����֪�þ������ⳤΪ516 pm����þ������ܶ�Ϊ___________g/cm3����ȷ��0.1��������ĺ���Ͱ���֮��ľ���Ϊ_______pm��
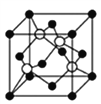
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������Ʒ���ʢ��CuSO4��Һ���ձ��У��ձ��з����ķ�Ӧ��
��2Na+CuSO4=Na2SO4+Cu
��Cu+2H2O=Cu(OH)2��+H2��
��2Na+2H2O=2NaOH+H2��
��2NaOH+CuSO4=Cu(OH)2��+Na2SO4
A���� B���٢� C���ۢ� D���٢�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��Һ����Fe3����Mg2����Fe2����Al3�����������ӣ��������м������������������Һ��������ټ�����������ᣬ��Һ�д������ٵ���������(����)
A. Fe3�� B. Mg2�� C. Fe2�� D. Al3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ����ˮú���ķ�ӦΪ��C��s��+H2O��g��![]() CO��g��+H2��g�� ��H=+131.4kJ��mol-1�����ж���ȷ����
CO��g��+H2��g�� ��H=+131.4kJ��mol-1�����ж���ȷ����
A����Ӧ�������ܺʹ��������������ܺ�
B��CO��g��+H2��g��![]() C��s��+H2O��g�� ��H=+131.4kJ��mol-1
C��s��+H2O��g�� ��H=+131.4kJ��mol-1
C��ˮú����Ӧ��������1 mol H2��g������131.4 kJ����
D��ˮú����Ӧ������1���CO��g������131.4 kJ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����״����H2��O2��1mol�����ǵ�
A. �����ͬ��������ͬ B. �����ͬ����������ͬ
C. �����ͬ��������ͬ D. �����ͬ��ԭ������ͬ
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com