
 (1)常温下取0.2mol/LHCl溶液与0.2mol/LMOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,试回答以下问题:
(1)常温下取0.2mol/LHCl溶液与0.2mol/LMOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,试回答以下问题:| c(H+)×c(F-) |
| c(HF) |
| c(HCO3-).c(OH-) |
| c(CO32-) |
| c(HCO3-).c(OH-).C(H+) |
| c(CO32-).c(H+) |
| KW |
| K2 |
| Kh.c(CO32-) |
| c(HCO3-).c(OH-) |
| c(CO32-) |
| c(HCO3-).c(OH-).C(H+) |
| c(CO32-).c(H+) |
| KW |
| K2 |
| 10-14 |
| 4.8×10-11 |
| Kh.c(CO32-) |
| 2.1×10-4×0.1 |


科目:高中化学 来源: 题型:
 关于如图实验的叙述正确的是( )
关于如图实验的叙述正确的是( )| A、X为Cl2.生成Cl2的电极反应:2Cl-→Cl2↑+2e- |
| B、阴极材料必须使用铂做电极 |
| C、在电解过程中,阴极附近的滴液会先呈现红色 |
| D、电解饱和食盐水的化学反应方程式:2NaCl+2H2O=Cl2↑+H2↑+2NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、二氧化硅溶于水显酸性 |
| B、光导纤维传导光的能力非常强,利用光缆通讯,能同时传送大量信息 |
| C、因为高温时二氧化硅与碳酸钠反应放出CO2,所以硅酸的酸性比碳酸强 |
| D、二氧化硅是酸性氧化物,它不溶于任何酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、对植物呼吸作用有利 |
| B、改良碱性土壤,调节pH |
| C、有利于土壤中的钙、镁离子被植物吸收 |
| D、加速光合作用进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:
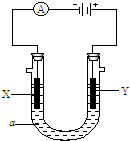 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、除去CO2中混有的少量SO2,可将气体通过饱和的碳酸氢钠溶液 |
| B、除去SiO2中混有的少量Al2O3,可以用NaOH溶液洗涤 |
| C、除去Fe粉中的少量Mg粉,可以将该粉末用稀硝酸洗涤,然后过滤 |
| D、除去NO2气体中混有的少量NO气体,可以向该气体中充入过量空气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 人工肾脏可用间接电化学方法除去代谢产物中的尿素,原理如右图.
人工肾脏可用间接电化学方法除去代谢产物中的尿素,原理如右图.查看答案和解析>>
科目:高中化学 来源: 题型:
 的系统名称为( )
的系统名称为( )| A、2,2,3-三甲基-1-戊炔 |
| B、3,4,4-三甲基-1-戊炔 |
| C、3,4,4-三甲基戊炔 |
| D、2,2,3-三甲基-4-戊炔 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com