
【题目】已知1~20号元素中A、B、C、D四种元素的原子中,质子数为A<B<C<D,A元素的原子最外层电子数是次外层电子数的2倍;B元素的原子核外M层电子数是L层电子数的一半;C元素的原子次外层电子数比最外层电子数多1个;D元素的原子核外K层。L层电子数之和等于M、N层电子数之和。试推断:
(1)元素B的原子结构示意图_______。
(2)C、D形成的化合物的电子式______。
(3)工业上由A元素的单质制取B元素的单质的化学方程式为____
(4)若没有“质子数为A<B<C<D”的限制,C还可以是____元素。
【答案】![]()
![]() SiO2+2C
SiO2+2C![]() Si+2CO↑ 锂或Li
Si+2CO↑ 锂或Li
【解析】
根据原子核外电子排布情况分析元素元素的种类并书写原子结构示意图;根据成键方式书写离子化合物的电子式;根据物质的性质书写相关反应方程式。
质子数为A<B<C<D,A元素的原子最外层电子数是次外层电子数的2倍,则A为碳;B元素的原子核外M层电子数是L层电子数的一半,则B为硅;C元素的原子次外层电子数比最外层电子数多1个,则C为氯;D元素的原子核外K层,L层电子数之和等于M、N层电子数之和,K层、L层,电子数依次为2、8,则M层、N层电子数依次为8、2,则D为钙;
(1)元素B为硅,核电荷数为14,则原子结构示意图为![]() ;
;
(2)C、D形成的化合物为氯化钙,属于离子化合物,电子式为![]() ;
;
(3)工业上用碳高温条件下还原二氧化硅制取硅单质,化学方程式为 SiO2+2C![]() Si+2CO↑;
Si+2CO↑;
(4)C元素的原子次外层电子数比最外层电子数多1个,C可能只有两个电子层,则C还可以是锂元素。


科目:高中化学 来源: 题型:
【题目】A,B,C,D是四种短周期元素,E是过渡元素。A,B,C同周期,C,D同主族,A的原子结构示意图为 ,B是同周期第一电离能最小的元素,C的最外层有三个未成对电子,E的外围电子排布式为3d64s2。试回答下列问题:
,B是同周期第一电离能最小的元素,C的最外层有三个未成对电子,E的外围电子排布式为3d64s2。试回答下列问题:
(1)写出下列元素的符号:A__________,B__________,C__________,D__________。
(2)用化学式表示上述五种元素中最高价氧化物对应水化物酸性最强的是________,碱性最强的是__________。
(3)用元素符号表示D所在周期第一电离能最大的元素是________,电负性最大的元素是__________。
(4)E元素原子的核电荷数是__________,E元素在周期表的第________周期第________族,已知元素周期表可按电子排布分为s区、p区等,则E元素在________区。
(5)写出D元素原子构成单质的电子式__________,该分子中有____个σ键,____个π键。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据题中信息完成下列填空题
(1)黄绿色气体单质X,与标况下密度为1.25g/L的烯烃Y发生加成反应,请写出烯烃Y的结构式__________。写出该加成产物的所有同分异构体结构简式______________。
(2)125℃,101kPa的条件下,某气态烯烃在氧气中充分燃烧后,气体体积没有变化,求出该烯烃的分子式________。
(3)某元素X的一种核素质量数为A,含N个中子,它与1H原子组成HmX分子。在a g HmX中所含质子的物质的量是___________mol。
(4)E和F均含有18个电子的微粒,E是所有18电子微粒中氧化能力最强的分子,请你写出E与水发生的化学反应方程式_______________。F是有两种元素组成的三原子分子,将其通入足量的NaOH溶液,发生的离子方程式_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为测定该补血剂样品[主要成分是硫酸亚铁晶体(FeSO4·7H2O)]中铁元素的含量,某化学兴趣小组设计了两套实验方案:
方案一:用酸性KMnO4溶液滴定测定铁元素的含量
(1)写出滴定反应的离子方程式 .
(2)下列滴定方式中,最合理的是 (夹持部分略去)(填字母序号).
(3)实验前,首先要准确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、玻璃棒、烧杯、胶头滴管外,还需 (填仪器名称).
方案二 将FeSO4转化为Fe2O3,测定质量变化操作流程如下:
(4)步骤②中除用H2O2外还可以使用的物质是 .
(5)步骤②是否可以省略 ,理由是 .
(6)步骤④中一系列操作依次是:过滤、洗涤、 、冷却、称量.
(7)假设实验无损耗,则每片补血剂含铁元素的质量 g(用含a的代数式表示).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中可以作为2NO2(g) ![]() 2NO(g)+O2(g)达到平衡状态的标志是( )
2NO(g)+O2(g)达到平衡状态的标志是( )
①单位时间内生成n mol O2的同时生成2n mol NO2;②单位时间内生成n mol O2的同时生成2n mol NO;③混合气体的颜色不再改变;④混合气体的密度不再改变的状态;⑤混合气体的平均相对分子质量不再改变的状态;⑥混合气体中NO与O2的物质的量之比保持恒定;⑦混合气体中NO与NO2的物质的量之比保持恒定
A. ①③⑤⑦ B. ②④⑤ C. ①③④ D. ①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在U形管中用惰性电极电解硫酸钠和石蕊的混合液,一段时间后,可以观察到的现象是( )
A. 两极附近颜色无明显变化 B. 两极产生等量气体
C. 阳极附近的颜色变红 D. 阴极附近的颜色变红
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钠(Na2FeO4)具有很强的氧化性,是一种新型的绿色净水消毒剂。工业上以菱铁矿(主要成分是FeCO3及少量SiO2)为原料制备高铁酸钠生产过程如下:
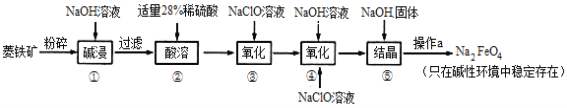
(1)Na2FeO4中铁元素的化合价为______,高铁酸钠用于杀菌消毒时的化学反应类型为_________(填“氧化还原”、“复分解”或“化合”)反应。
(2)按照上述流程,步骤①中碱浸时能否用较便宜的Ca(OH)2替代NaOH_____(填“能”或“不能”),理由是______________________________________________。
(3)步骤②中28%的稀硫酸需要用98%的浓硫酸配制,配制时所需玻璃仪器除量筒外,还需要______(填字母序号)。
A.容量瓶 B.烧杯 C.圆底烧瓶 D.玻璃棒
(4)步骤④中除生成Na2FeO4外,还有NaCl生成,其离子方程式为_________________已知步骤⑤是向Na2FeO4溶液中继续加入氢氧化钠固体得到悬浊液,则操作a的名称为_________。
(5)理论上,每获得0.5 mol的FeO42-消耗NaClO的总质量为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.金属钠应保存在水里以隔绝空气
B.常温下铁能与水蒸气反应生成氢气
C.可以用铁制品或铝制品容器盛放浓H2SO4
D.铝较活泼,所以铝制品在空气中不能稳定存在
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com